โครงสร้างอะตอม ตอนที่ 1 แบบจำลองอะตอม
ในทางดาราศาสตร์เชื่อว่าเอกภพหรือจักรวาล (Universe) อุบัติขึ้นเมื่อประมาณ 13,000
ล้านปีมาแล้วตามทฤษฏีบิกแบง (big bang) คำว่าเอกภพมีความหมายรวมถึงทุกสรรพสิ่ง ได้แก่
ดาราจักร์ (Galaxcy) เนบิวลา (Nebula) ระบบสุริยะ (Solar system) ดาวฤกษ์ (sphere , star) ดาวเคราะห์ (Planet) ดาวเคราะห์น้อย (asteroid) ดาวเคราะห์แคระ (dwarf
planet) ดาวหาง
(comet) สะเก็ดดาว (meteoroid) สสาร (metter) พลังงาน (energy) อวกาศ (outer space) หลุมดำ (black hole) เวลา (time)
บรรดาสิ่งทั้งหลายที่เป็นวัตถุจะประกอบขึ้นด้วยองค์ประกอบขนาดเล็กเรียกว่าอะตอม
(atom) ซึ่งนักปราชญ์ชาวกรีก 2
คนคือ ลูซิพปุส (Leucippus) และดิโมคริตุส (Democritus) กล่าวว่าทุกสิ่งทุกอย่างประกอบขึ้นจากอะตอมซึ่งมีขนาดเล็กมากและเป็นสิ่งที่แบ่งแยกไม่ได้
เมื่อประมาณ 2,400 ปีมาแล้ว
ปัจจุบันมีการศึกษาเพิ่มเติมเกี่ยวกับอะตอมกันอย่างกว้างขวาง ทำให้ทราบว่าในอะตอมซึ่งมีขนาดเล็กที่สุดดังกล่าวและ
แบ่งแยกไม่ได้นั้น ยังประกอบด้วยอนุภาคขนาดเล็กกว่าอีกอย่างน้อย 3 ชนิด
คือ อิเล็กตรอน โปรตอนและนิวตรอน แต่อนุภาคเหล่านั้นอยู่ตามลำพังไม่ได้ ฉะนั้นแต่อะตอมจึงเป็นอนุภาค (particle)
ที่เล็กที่สุดที่อยู่ตามลำพังได้และแสดงความเป็นธาตุต่าง ๆ ได้
ถ้าวัตถุทั้งก้อนประกอบด้วยอะตอมของธาตุชนิดเดียวทุกอะตอม วัตถุนั้นจะมีสมบัติเป็นสารบริสุทธิ์ที่เรียกว่าธาตุ
(elements) ปัจจุบันพบว่ามีทั้งหมด 118
ธาตุ
ส่วนหนึ่งเป็นธาตุที่มีอยู่ตามธรรมชาติ
อีกส่วนหนึ่งเป็นธาตุที่ได้จากการสังเคราะห์ เช่น ทองคำบริสุทธิ์จะประกอบด้วยอะตอมของทองคำล้วน
ๆ สำหรับธาตุบริสุทธิ์อื่น ๆ ก็จะประกอบด้วยอะตอมของธาตุนั้น ๆ เช่นกัน ซึ่งอะตอมของธาตุแต่ละชนิดจะมีสมบัติเฉพาะตัวที่แตกต่างกัน
คือมีจำนวนอิเล็กตรอน โปรตรอนและนิวตรอน เป็นจำนวนเฉพาะของแต่ละธาตุ
ในบรรดาอะตอมของธาตุทั้งหลายนั้น อะตอมของธาตุไฮโดรเจนเป็นอะตอมของธาตุที่เกิดขึ้นเป็นอันดับแรกในจักรวาล เมื่อประมาณ 1.37 x 1010
ปี หรือ 13,700,000,000 ปี ปีมาแล้วจากเหตุการณ์ Big Bang อันเป็นที่มาของสรรพสิ่งทั้งหลายทั้งปวงในจักรวาลหรือเอกภพ
(universe) มาจนถึงทุกวันนี้ ก่อนหน้านั้นเป็นอย่างไรไม่มีใครบอกได้
(คลิ้ก ชม Big Bang แสดงกำเนิดแห่งจักรวาลและโลกของเรา)
ธาตุและสัญลักษณ์ของธาตุ
(Elements
Symbol)
ธาตุแต่ละชนิดเป็นสารบริสุทธิ์ที่ประกอบขึ้นดวยอะตอมของธาตุนั้น
ๆ ในยุคแรก ๆ
ที่ยังค้นพบธาตุไม่มากนัก จอห์น ดาลตัน เป็นคนแรกที่เสนอให้ใช้รูปภาพเป็นสัญลักษณ์แทนธาตุแต่ละธาตุ เช่น

เมื่อมีการค้นพบธาตุมากขึ้น
การใช้รูปภาพเป็นสัญลักษณ์ของธาตุเริ่มมีความยุ่งยากและสับสน จึงมีแนวคิดที่จะใช้ตัวอักษรเป็นสัญลักษณ์ของธาตุ โจนส์
จาคอบ เบอร์ซีเลียส (คลิ้ก อ่านประวัติ) เป็นผู้เสนอให้ใช้ตัวอักษรเป็นสัญลักษณ์ของธาตุต่าง
ๆ แทนการใช้รูปภาพ กำหนดหลักการเขียนดังนี้
1. ถ้าธาตุนั้นมีชื่อภาษาละติน ให้ใช้ตัวอักษรตัวแรกจากชื่อในภาษาละตินมาเป็นสัญลักษณ์ของธาตุโดยใช้ตัวอักษรภาษาอังกฤษ
ชนิดตัวพิมพ์ใหญ่ ถ้าอักษรตัวแรกซ้ำกับสัญลักษณ์ของธาตุอื่น ให้เพิ่ม ตัวอักษรตัวถัดไปตัวใดตัวหนึ่งเขียนด้วยตัวพิมพ์เล็ก
เช่น ธาตุโพแทสเซียม ชื่อภาษาละติน Kalium สัญลักษณ์ของธาตุ คือ K ธาตุเงิน ชื่อภาษาละติน Argentum
สัญลักษณ์ของธาตุ คือ Ag ไม่ ใช้ Ar เพราะซ้ำกับ Argon
2. ถ้าธาตุนั้นไม่มีชื่อเป็นภาษาละติน
ให้ใช้ชื่อภาษาอังกฤษ ใช้อักษรตัวแรกเป็นสัญลักษณ์ เขียนด้วยตัวพิมพ์ใหญ่ แต่ถ้าซ้ำกับธาตุอื่นให้ใช้ตัวอักษรตัวต่อ
ๆ ไป อีก
1 ตัว เขียนด้วยตัวพิมพ์เล็ก เช่น ธาตุคาร์บอน ชื่อภาษาอังกฤษ Carbon สัญลักษณ์ของธาตุ
คือ C ธาตุแคลเซียม
Calcium
สัญลักษณ์คือ Ca ธาตุโคบอลต์ Cobalt สัญลักษณ์คือ Co ….
ธาตุและสัญลักษณ์ของธาตุที่ควรทราบมีดังต่อไปนี้
ธาตุหมู่ที่ 1A โลหะอัลคาไลน์ (alkali metal) มี 6 ธาตุ
ดังนี้
ชื่อธาตุ สัญลักษณ์
Lithium (ลิเทียม) Li
Sodium (โซเดียม) Na
Potassium (โพแทสเซียม) K
Rubidium (รูบิเดียม) Rb
Caesium (ซีเซียม) Cs
Francium (แฟรนเซียม) Fr
หมู่ที่ 2A โลหะอัลคาไลน์ เอิร์ธ (alkali earth metal) มี 6 ธาตุ ดังนี้
ชื่อธาตุ สัญลักษณ์
Beryllium (เบริลเลียม) Be
Magnesium (แมกนีเซียม) Mg
Calcium (แคลเซียม) Ca
Strontium (สตรอนเตียม) Sr
Barium (แบเรียม) Ba
Radium (เรเดียม) Ra
ธาตุหมู่ที่ 3A มี 6 ธาตุ ดังนี้
ชื่อธาตุ สัญลักษณ์
Boron (โบรอน) B
Aluminium (อลูมิเนียม) Al
Gallium (แกลเลียม) Ga
Indium (อินเดียม) In
Thallium (เทลเลียม) Ti
Nihonium (นิโฮเนียม) Nh
ธาตุหมู่ที่ 4A มี 6
ธาตุ ดังนี้
ชื่อธาตุ สัญลักษณ์
Carbon (คาร์บอน) C
Silicon (ซิลิคอน) Si
Germanium (เจอร์มาเนียม) Ge
Tin (ทิน) Sn
Lead (เลด) Pb
Flerovium (เฟลโรเวียม) Fl
ธาตุหมู่ที่ 5A มี 6
ธาตุ ดังนี้
ชื่อธาตุ สัญลักษณ์
Nitrogen (ไนโตรเจน) N
Phosphorus (ฟอสฟอรัส) P
Arsenic (อาร์เซนิก) As
Antimony (อันตืโมนี) Sb
Bismuth (บิสมัธ) Bi
Moscovium (มอสโคเวียม) Mc
ธาตุหมู่ที่ 6A
(chalcogens) มี 6
ธาตุ ดังนี้
ชื่อธาตุ สัญลักษณ์
Oxygen (ออกซิเจน) O
Sulfur (ซัลเฟอร์) S
Selenium (ซิลิเนียม) Se
Tellurium (เทลลูเลียม) Te
Polonium (โพโลเนียม) Po
Livermorium (ลิเวอร์โมเลียม) Lv
ธาตุหมู่ที่ 7A (halogens)
มี 6 ธาตุ
ดังนี้
ชื่อธาตุ สัญลักษณ์
Flurorine (ฟลูออรีน) F
Chlorine (คลอรีน) Cl
Bromine (โบรมีน) Br
Iodine (ไอโอดีน) I
Astatine (แอสตาติน) At
Tennessine (เทนเนสซิน) Ts
ธาตุหมู่ที่ 8A (noble gas) มี 7 ธาตุ
ดังนี้
ชื่อธาตุ สัญลักษณ์
Helium (ฮีเลียม) He
Neon (นีออน) Ne
Argon (อาร์กอน) Ar
Kryptron (คริพตรอน) Kr
Xenon (ซีนอน) Xe
Radon (เรดอน) Rn
Organesson (ออร์กานิซอน) Og
ธาตุแทรนซิชันคาบที่ 4
มี 10 ธาตุ
ดังนี้
ชื่อธาตุ สัญลักษณ์
Scandium (สแกนเดียม) Sc
Titanium (ไททาเนียม) Ti
Vanadium (วาเนเดียม) V
Chromium (โครเมียม) Cr
Manganese (แมงกานีส) Mn
Iron (ไอร์ออน) Fe
Cobalt (โคบอลต์) Co
Nikle (นิกเกิล) Ni
Copper (คอปเปอร์) Cu
Zinc (ซิงค์) Zn
ธาตุอื่น ๆ ที่ควรทราบ
ชื่อธาตุ สัญลักษณ์
Hydrogen (ไฮโดรเจน) H
Rhodium (โรเดียม) Rh
Palladium (แพลเลเดียม) Pd
Silve (ซิลเวอร์) Ag
Cadmium (แคดเมียม) Cd
Tungsten (ทังสเตน) W
Platinum (แพลตทินัม) Pt
Gold (โกลด์) Au
Mercury (เมอร์คิวรี) Hg
Uranium (ยูเรเนียม) U
Plutonium (พลูโตเนียม) Pu
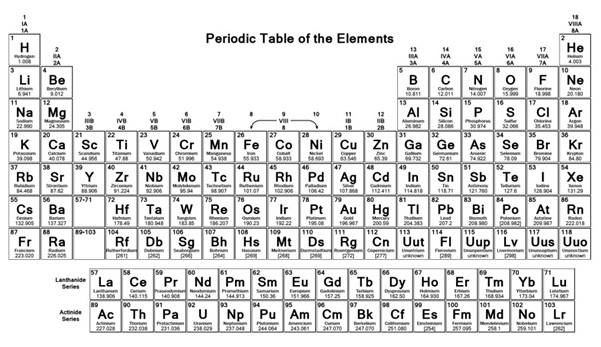
บรรดาธาตุต่าง ๆ
เหล่านี้ปัจจุบันจัดไว้ในตารางธาตุ
โดยเรียงลำดับตามจำนวนโปรตอน
หรือเลขเชิงอะตอม (atomic number) จากน้อยไปมาก จากซ้ายไปขวา
ธาตุที่อยู่ในแนวนอนเดียวกัน เรียกว่าคาบ (period) ธาตุที่อยู่ในแนวตั้งเดียวกันเรียกว่าหมู่
(group)
(คลิ้ก
ทดสอบความสามารถในการจำชื่อและสัญลักษณ์ของธาตุ)
แบบจำลองอะตอม
(atomic
model)
อะตอมมีขนาดเล็กมากมองด้วยตาเปล่าไม่เห็น แม้จะใช้กล้องจุลทรรศน์อิเล็กตรอนที่มีกำลังขยายได้นับแสนเท่าก็ยังไม่เห็นอะตอมที่แท้จริง ดังภาพต่อไปนี้ (ซ้าย) เป็นภาพพื้นผิวของแผ่น ซิลิคอน จุดที่เห็นมีขนาด 0.33 นาโนเมตร (0.33 nm
, 1 nm = 10-9 m) จุดดังกล่าวไม่สามารถยืนยันได้ว่าเป็นอะตอมของซิลิคอนหรือไม่ (ขวา) คือกล้องจุลทรรศน์อิเล็กตรอนชนิดหนึ่ง
ดูภาพและคำอธิบายต่อไปนี้

I don't actually think you can have
a crisp photo of an atom. For one thing, the nucleus is tiny in compariton to
the 'orbit' of the electron and secondly, the electron doesn't 'orbit' around
the nucleus - it merely exists somewhere/everywhere near an atom but probably
within specific orbits. Thirdly, the nucleus isn't solid, you can't stick a pin
in an proton - again, its more of a high point of energy.
(อย่าเพิ่งมั่นใจว่าภาพที่เห็นนี้คือภาพของอะตอม แต่ให้สังเกตว่า 1.
นิวเคลียสมีขนาดเล็กมากเมื่อเปรียบเทียบกับขนาดวงโคจรของอิเล็กตรอน 2.
อิเล็กตรอนอาจไม่ได้โคจรรอบนิวเคลียสเป็นวง เสมอไปก็ได้ แต่อาจมีที่อยู่ ณ
ส่วนใดส่วนหนึ่งหรือทุกส่วนในอะตอม
แต่ที่อยู่ดังกล่าวอาจต่อเนื่องกันเป็นวง 3.นิวเคลียสอาจไม่ได้เป็นของแข็งก็ได้ แต่มันอาจเป็นสิ่งที่มีพลังงานสูงอย่างมาก)
Any photos you manage to
get are going to be a tiny spec of dust in the centre with a tennis court size
area of what is probably an electron.
(จากภาพจะเห็นได้ว่าถ้าจะพูดถึงขนาดของอิเล็กตรอนกันแล้ว ก็เปรียบเสมือนฝุ่นธุลีเล็ก ๆ
ที่ตกอยู่กลางสนามเทนนิสอันกว้างใหญ่)
The best shots of an atom
you are likely to get are those done by IBM with its scanning/tunneling
microscope which plots point where the field around an atom becomes a certain
strength. (or something like that)e.g.
(ภาพนี้นับว่าเป็นภาพที่เกี่ยวข้องกับอะตอมที่สุดยอดภาพหนึ่ง ซึ่งถ่ายโดยกล้องจุลทรรศน์อิเล็กตรอนของ
IBM )
การที่เรายังไม่ทราบว่าอะตอมที่แท้จริงมีรูปร่างอย่างไร และมีอะไรเป็นส่วนประกอบบ้าง จึงมีความพยายามศึกษาเกี่ยวกับอะตอมในแง่มุมต่าง
ๆ จากนักวิทยาศาสตร์อย่างกว้างขวาง เพื่อต้องการ ทราบว่าอะตอมมีรูปร่างอย่างไรกันแน่ และประกอบด้วยอะไรบ้าง แต่จนถึงขณะนี้ (พ.ศ. 2558) ยังไม่มีเครื่องมือชนิดใดที่จะทำให้มนุษย์มองเห็นอะตอมที่แม้จริงขึ้นมาได้ จึงต้องใช้ผลการทดลองทาง วิทยาศาสตร์ที่เกี่ยวกับอะตอม นำมาจินตนาการว่าอะตอมมีรูปร่างอย่างไร โดยที่ความจริงยังไม่ได้เห็นว่าอะตอมมีรูปร่างอย่างนั้นจริงหรือไม่ รูปร่างของอะตอมที่ได้มาโดยวิธีนี้จึงเป็นเพียงแบบจำลอง อะตอม
(Atomic model) เท่านั้น ไม่ใช่รูปร่างของอะตอมที่แท้จริง ฉะนั้นถ้ามีผลการทดลองใหม่ ๆ
ที่ไม่สอดคล้องกับแบบจำลองอะตอมที่มีอยู่เดิม
หรือแบบจำลองอะตอมที่มีอยู่เดิมไม่สามารถ อธิบายผลการทดลองใหม่ ๆ ได้ ก็จะมีการเสนอแบบจำลองอะตอมขึ้นมาใหม่อีก ฉะนั้นแบบจำลองอะตอมจึงมีการเปลี่ยนแปลงมาแล้วหลายแบบ
ดังจะได้ศึกษากันต่อไปนี้
ก่อนอื่นให้เข้าใจว่าการศึกษาเรื่องอะตอมมีรายละเอียดมาก จะไม่พูดแบบรวบรัดตัดตอนว่านักวิทยาศาสตร์คนนั้นรู้ว่าในอะตอมมีสิ่งนั้น คนนี้รู้ว่ามีสิ่งนี้แล้วก็สรุปว่าอะตอมประกอบด้วยสิ่งนั้นสิ่งนี้แล้ว ก็จบ
ที่ให้รายละเอียดมากในแต่ละขั้นตอนเป็นเพราะการค้นพบเกี่ยวกับอะตอมเป็นเรื่องใหญ่ ทั้งที่อะตอมมีขนาดเล็กมาก ต้องการให้เห็นการทำงานของนักวิทยาศาสตร์แต่ละคนว่า มีขั้นตอนและ กระบวนการทำงานอย่างไร นำผลการทดลองไปเชื่อมโยงกับรูปร่างอะตอมได้อย่างไร ให้ดูแบบอย่างวิธีคิด การสังเกต
การเก็บรวบรวมข้อมูล การใช้เหตุผลในการเชื่อมโยงข้อมูลต่าง
ๆ เพื่อนำไปสู่ คำตอบของสิ่งที่ต้องการศึกษา
การทำงานของนักวิทยาศาสตร์เหล่านี้ใช้เป็นแบบอย่างในการทำงานของเราได้เป็นอย่างดี
ผู้ที่กล่าวถึงคำว่าอะตอมเป็นคนแรกคือนักปราชญ์ชาวกรีกชื่อ
เดโมคริตุส ( Democritus ) โดยกล่าวไว้เมื่อประมาณ 2,400 ปีมาแล้ว กล่าวว่าถ้าตัดวัตถุชิ้นหนึ่งให้มีขนาดเล็กลงตามลำดับ ในที่สุดจะไม่สามารถตัดให้เล็กลงได้อีก สิ่งนั้นจึงเป็นสิ่งที่เล็กที่สุด เรียกสิ่งนั้นว่า “atomos” แปลว่าแบ่งไม่ได้ ต่อมาจึงใช้คำว่า atom
(คลิ้กอ่านเพิ่มเติม)
(คลิ้ก อ่านอะตอมในเรื่องกามนิต-วิสิฏฐี อยู่หน้า 15)
(อ่านกามนิต-วาสิฎฐี ฉบับเต็ม คลิ๊กที่นี่)
ในที่นี้จะได้ศึกษาแบบจำลองอะตอมแต่ละแบบ และอนุภาคมูลฐานของอะตอมตามลำดับของช่วงเวลาที่มีการค้นพบหรือนำเสนอ โดยนักวิทยาศาสตร์แต่ละคน ประกอบด้วย
1. แบบจำลองอะตอมของดาลตัน (Ddlton
atomic’s model) พ.ศ. 2351
2. แบบจำลองอะตอมของทอมสัน (Thomson ‘s atomic model) พ.ศ. 2447
3. แบบจำลองอะตอมของรัทเทอร์ฟอร์ด (Rutherford’s
atomic model) พ.ศ. 2454
4. แบบจำลองอะตอมของโบรห์ (N. Bohr (1940) provided the modern concept of the
atomic
model) พ.ศ. 2456
5. แบบจำลองอะตอมชนิดกลุ่มหมอกอิเล็กตรอน (Electron cloud model)
พ.ศ. 2505
การศึกษาเกี่ยวกับอะตอมมีความสลับซับซ้อน
มีลำดับของการค้นพบและการนำเสนอข้อมูลแต่ละด้านเป็นเวลาต่อเนื่องยาวนาน ระหว่าง ค.ศ. 1808 หรือ พ.ศ
2351 ถึง ค.ศ. 1926 หรือ พ.ศ. 2469 ซึ่งเป็นช่วงเวลาที่นานถึง 118 ปี
เมื่อเปรียบเทียบกับเหตุการณ์ในประเทศไทยจะอยู่ระหว่างสมัยรัชกาลที่ 1 พระบาทสมเด็จพระปรโมรุราชามหาจักรีบรมนารถ
พระพุทธยอดฟ้าจุฬาโลก (20 มีนาคม พ.ศ.
2279 ถึง 7 กันยายน พ.ศ. 2352) ถึงสมัยรัชกาลที่ 7 ระหว่า พ.ศ. 2468 ถึง พ.ศ.2477
ลำดับเหตุการณ์และการค้นพบที่สำคัญโดยย่อมีดังนี้
- John Dalton (1808 , 2351) proposed the Atomic Theory. According to Dalton,
matter is made up of tiny particles called atoms. The atom is the smallest
particle of matter that takes part in a chemical reaction. Atoms are
indivisible and cannot be created or destroyed. Further, atoms of the same
element are identical in every respect.
(ปี ค.ศ. 1808 หรือ พ.ศ.
2351จอห์น ดาลตัน กล่าวว่าวัตถุทุกชนิดประกอบขึ้นด้วยอะตอม ซึ่งเป็นอนุภาคที่เล็กที่สุด
ซึ่งไม่สามารถแบ่งแยกต่อไปได้ด้วยปฏิกิริยาเคมี และเป็นสิ่งที่จะสร้างขึ้นมาใหม่หรือทำลายให้สูญหายไปก็ไม่ได้ อะตอมของธาตุเดียวกันจะมีสมบัติต่าง ๆ
เหมือนกัน )
- J. J. Thomson (1904 , 2447) discovered
electrons in
Cathode Ray experiments. According to Thomson, atoms are divisible. Atoms
contain very tiny negatively charged particles called electrons.
(ปี ค.ศ. 1904 หรือ
พ.ศ. 2477 J.J.
Thomson เป็นผู้พบอิเล็กตรอน
จาก ทดลองโดยใช้หลอดรังสีแคโทด
ทำให้ทราบว่าอะตอมประกอบด้วยอนุภาคซึ่งมีประจุลบ เรียกว่าอิเล็กตรอน)
- E. Goldstein (1900 , 2443) discovered protons in Anode Ray experiments.
According to Goldstein, atoms contain positively charged particles called
protons. Since atoms contain negatively charged particles, they must
contain positively charged particles for them to be electrically neutral.
(ปี 1900 พ.ศ. 2443 โกลด์สไตน์ เป็นผู้ค้นพบโปรตอน จากการทดลองเพิ่มเติมเกี่ยวกับรังสีแอโนด หรือรังสีแคลแนล ทำให้ทราบว่าอะตอมประกอบด้วยอนุภาคอีกชนิดหนึ่งซึ่งมีประจุบวก เรียกว่าโปตอน อิเล็กตรอนและโปรตอนมีประจุไฟฟ้าตรงกันข้ามจึงหักล้างกันหมดไป ทำให้อะตอมในภาวะปกติเป็นกลางทางไฟฟ้า )
* กรณีนี้มีข้ออ้างอิงหลายแห่งต่างกัน
บ้างก็กล่าวว่าผู้พบโปรตอนคือรัทเทอร์ฟอร์ด
(คลิ้ก)
- E. Rutherford (1911 , 2454) discovered the
nucleus and
provided the basis for the modern atomic structure through his alpha
particle scattering experiment. According to Rutherford, the atoms is made
of two parts: the nucleus and the extra-nuclear part. His experiments
proved that the atom is largely empty and has a heavy positively-charged
body at the center called the nucleus. The central nucleus is
positively-charged and the negatively-charged electrons revolve around the
nucleus.
(ปี 1911 พ.ศ. 2454 รัทเทอร์ฟอร์ด พบว่าอะตอมมี 2 ส่วน คือนิวเคลียสซึ่งมีมวลมาก มีประจุบวก เป็นศูนย์กลางของอะตอม กับสิ่งที่อยู่รอบ ๆ นิวเคลียสคืออิเล็กตรอน)
- James Chadwick (1932 , 2475) disovered
neutrons.
According to Chadwick, atoms contain neutral particles called neutrons in
their nucleus along with the subatomic particles (i.e., electrons and
protons).
(ปี 1932 พ.ศ. 2475 James Chadwick พบว่าอะตอมประกอบด้วยอนุภาคอีกชนิดหนึ่งซึ่งไม่มีประจุไฟฟ้า เรียกว่า นิวตรอน)
- N. Bohr (1913 , 2456) provided the modern
concept of the atomic model. According to Bohr, the atom is made of a
central nucleus containing protons (positively-charged) and neutrons (with
no charge). The electrons (negatively-charged) revolve around the nucleus
in different imaginary paths called orbits or shells.
(ปี 1913 พ.ศ. 2456
N. Bohr พบว่าอะตอมประกอบด้วยนิวเคลียสที่เกิดจากโปรตอนรวมกันอยู่จึงมีประจุบวก แต่อิเล็กตรอนซึ่งมีประจุลบจะที่โคจรรอบนิวเคลียสแบ่งออกเป็นชั้น
ๆ เรียกว่าระดับพลังงาน)
- The electron cloud model or Quantum mechanical
model (1926 . 2469) These ideas were developed by Erwin Schrödinger and Werner
Heisenberg. The model provides the means of
visualising the position of electrons in an atom This meant that electrons,
instead of traveling in defined orbits or hard, spherical “shells,” as
Bohr proposed, travel in diffuse clouds around the nucleus.
(ปี 1926 พ.ศ. 2469 Schrödinger และ Werner Heisenberg
เสนอแบบจำลองอะตอมจากตำแหน่งที่พบอิเล็กตรอนของแต่ละอะตอม )
Content's Picture

Size : 4.69 KBs
Upload : 2014-03-15 06:04:52
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|