ปริมาณสารสัมพันธ์ ตอนที่ 7 สมบัติคอลิเคทีป
การเพิ่มขึ้นของจุดเดือดและการลดลงของจุดเยือกแข็งของสารละลาย
ความแตกต่างประการหนึ่งระหว่างสารบริสุทธิ์กับสารละลายก็คือ การมีจุดเดือดและจุดเยือกแข็งที่ต่างกัน กล่าวคือสารบริสุทธิ์จะมีจุดเดือดคงที่
ในขณะที่จุดเดือดของสารละลายไม่คงที่ เช่น น้ำบริสุทธิ์มีจุดเยือกแข็ง(จุดหลอมเหลว) 0 oC และมีจุดเดือดปกติเท่ากับ 100.0 oC คงที่
(คลิ้ก ชมจุดหลอมเหลวและจุดเดือดของสารบริสุทธิ์)
แต่เมื่อมีสารใด ๆ ละลายอยู่ในน้ำแล้วจุดเดือดจะไม่คงที่ โดยมีความเป็นไปได้ 2 แบบ คือ
- ถ้าตัวละลายเป็นสารที่ไม่ระเหย เช่น น้ำตาลกลูโคส น้ำตาลทราย เกลือ สารละลายจะมีจุดเดือดสูงกว่า 100.0 oC ยิ่งความเข้มข้นเพิ่มขึ้นจุดเดือดก็จะเพิ่มขึ้นตามไปด้วย
- ถ้าพิจารณาการเปลี่ยนแปลงขณะที่สารละลายเดือดจะพบว่าตัวทำละลายจะค่อย ๆ ระเหยไป แต่ตัวละลายไม่ได้ระเหยไปด้วยความเข้มข้นของสารละลายจึงค่อย ๆ เพิ่มขึ้น
- ถ้าเราติดตามสังเกตจุดเดือดของสารละลายไปด้วย จะพบว่าจุดเดือดค่อย ๆ เพิ่มขึ้น ดังกราฟ
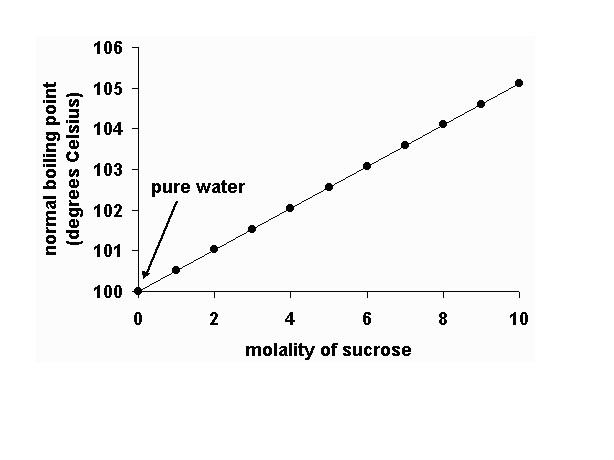
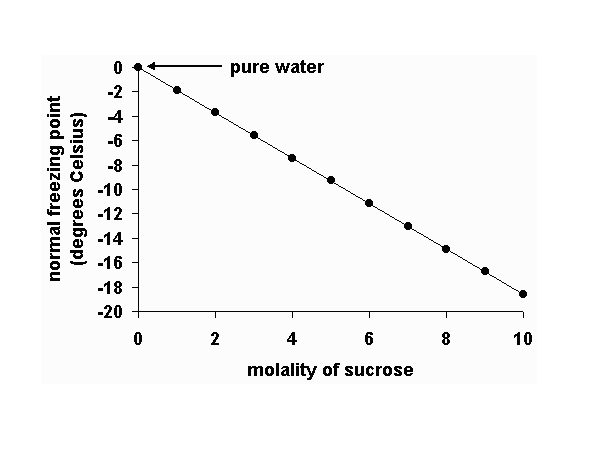
ในทางกลับกันถ้าเราศึกษาจุดเยือกแข็ง(จุดหลอมเหลว)ของสารละลาย นำมาเปรียบเทียบกับจุดเยือกแข็งของตัวทำละลายบริสุทธิ์บ้างจะพบว่า
สารละลายมีจุดเยือกแข็งต่ำกว่าจุดเยือกแข็งของตัวทำละลายบริสุทธิ์ โดยสารละลายที่มีความเข้มข้นมากจุดเยือกแข็งยิ่งต่ำลง ดังกราฟ
2. ถ้าสารละลายเกิดจากตัวละลายที่ระเหยได้ เช่น เอทานอลละลายในน้ำ สารละลายจะมีจุดเดือดต่ำกว่า 100.0 oC ขณะเดือดก็จะเกิดการระเหยของทั้งตัวละลาย
คือเอทานอลและตัวทำละลายคือน้ำ แต่เอทานอลระเหยได้เร็วกว่าน้ำ มีผลให้ความเข้มข้นของสารละลายส่วนที่เหลือค่อย ๆ ลดลง ถ้าติดตามจุดเดือดของสารละลาย
จะพบว่าจุดเดือดจะค่อย ๆ เพิ่มขึ้น แต่ในที่สุดจะไม่สูงกว่าจุดเดือดของตัวทำละลายบริสุทธิ์
แต่อย่างไรก็ตามสารละลายบางชนิดมีจุดเดือดคงที่ เรียกว่า อะซีโอโทป ( Azeotropic mixture) เช่น เอทธานอล 95% มีจุดเดือดคงที่ที่ 78.2 0C
กรดไฮโดรคลอริก 20.22% มีจุดเดือดคงที่ที่ 108.6 0C การที่สารละลายประเภทนี้มีจุดเดือดคงที่เกิดจากขณะเดือดนั้น ทั้งตัวทำละลายและตัวละลายระเหยได้ในอัตราส่วนเดียวกัน
ทำให้สารละลายมีความเข้มข้นคงที่จุดเดือดจึงคงที่
สารละลายที่มีการเพิ่มขึ้นของจุดเดือดและการลดลงของจุดเยือกแข็งอย่างเป็นระบบมากที่สุดคือ สารละลายที่มีความเข้มข้นในหน่วยโมล/กิโลกรัม หรือโมแลล
พบว่าสารละลายที่มีตัวทำละลายเป็นสารเดียวกัน แต่ตัวละลายเป็นสารต่างชนิดกัน(เป็นสารที่ไม่ระเหย) ถ้ามีความเข้มข้นเท่ากัน จะมีจุดเดือดและจุดเยือกแข็ง(หลอมเหลว)เท่ากัน
เช่น สารละลายน้ำตาลกลูโคส กับสารละลายน้ำตาลทราย ทั้ง 2 ชนิดนี้ตัวทำละลายเป็นสารเดียวกันคือน้ำ ถ้าทั้ง 2 ชนิดมีความเข้มข้น 1.0 โมล/กิโลกรัม จะมีจุดเดือดเท่ากับ
100.51 oC ทั้ง 2 ชนิด และมีจุดเยือกแข็ง -1.86 oC ทั้ง 2 ชนิด
|
|
|
สารละลายน้ำตาลกลูโคส สารละลายน้ำตาลทราย
ความเข้มข้น 1 โมแลล ความเข้มข้น 1 โมแลล
จุดเดือด 100.51 oC จุดเดือด 100.51 oC
|
เราเรียกสมบัติประเภทนี้ว่าสมบัติคอลิเกตีป (colligative properties) หมายถึงสมบัติที่ไม่ขึ้นอยู่กับชนิดของสาร แต่ขึ้นอยู่กับปริมาณของสาร ในทางตรงข้าม
มีสมบัติของสารอีกมากมายที่เป็นไปในทางตรงกันข้ามคือไม่ขึ้นอยู่กับปริมาณของสารแต่ขึ้นอยู่กับชนิดของสาร เช่น ความหนาแน่น วัตถุชนิดเดียวกันไม่ว่าชิ้นใหญ่หรือเล็ก
ก็มีความหนาแน่นเท่าเดิม จุดเดือดของสารบริสุทธิ์ก็เช่นกัน ไม่ว่าจะมากหรือน้อยจุดเดือดก็เท่าเดิม เรียกว่าสมบัติอินเทนซีป (intensive properties)
จุดเดือดที่เพิ่มขึ้นของสารละลายที่มีความเข้มข้น 1.0 โมล/กิโลกรัม เรียกว่าค่าคงที่ของการเพิ่มขึ้นของจุดเดือด (ebullioscopic constants ; Kb)
โดยตัวทำละลายแต่ละชนิดจะมีค่าคงที่ของการเพิ่มขึ้นของจุดเดือด (Kb) เป็นค่าเฉพาะตัว เช่น
|
ตัวทำละลาย
|
จุดเดือดปกติ
ของตัวทำละลายบริสุทธิ์ oC
|
Kb, oC m-1
|
|
Water, H2O
|
100.0
|
0.512
|
|
acetic acid , CH3COOH
|
118.1
|
3.07
|
|
Benzene , C6H6
|
80.1
|
2.53
|
|
Chloroform , CHCl3
|
61.3
|
3.63
|
|
Nitrobenzene , C6H5NO2
|
210.9
|
5.24
|
จากตารางเป็นตัวอย่างของตัวทำละลาย 5 ชนิด สังเกตที่ค่า Kb จะเห็นว่าเป็นค่าเฉพาะของแต่ละสาร แต่มีความหมายเหมือนกันคือถ้าเตรียมสารละลายจากตัวทำละลายเหล่านี้
ให้มีความเข้มข้น 1.0 โมล/กิโลกรัมเท่ากัน โดยไม่จำกัดว่าตัวละลาย (solute) จะเป็นสารใด สารละลายที่ได้ก็จะมีจุดเดือดเพิ่มขึ้นเท่ากับค่า Kb ของตัวทำละลายนั้น ๆ เช่น
|
ตัวทำละลาย
|
จุดเดือดปกติ
ของตัวทำละลายบริสุทธิ์ oC
|
Kb, oC m-1
|
จุดเดือดของสารละลาย
ที่มีความเข้มข้น
1.0 โมล/กิโลกรัม(oC)
|
|
water
H2O
|
100.0
|
0.512
|
100.0+0.512
= 100.512
|
|
acetic acid
CH3COOH
|
118.1
|
3.07
|
118.1+3.07
= 121.17
|
|
Benzene
C6H6
|
80.1
|
2.53
|
80.1+2.53
= 82.63
|
|
Chloroform
CHCl3
|
61.3
|
3.63
|
61.3+3.63
= 64.93
|
|
Nitrobenzene
C6H5NO2
|
210.9
|
5.24
|
210.9+5.24
= 216.14
|
ตัวอย่าง สารละลายที่เกิดจาก C6H12O6 1.80 กรัม ละลายในน้ำบริสุทธิ์ 100 กรัม สารละลายจะมีจุดเดือดกี่ oC (Kb ของน้ำ = 0.51 oC m-1)
วิธีทำ จำนวนโมลของ C6H12O6 ; n = W/M = 1.8/180 = 0.010 โมล
น้ำบริสุทธิ์ 100 กรัม มี C6H12O6 ละลายอยู่ 0.010 โมล
น้ำบริสุทธิ์ 1,000 กรัม มี C6H12O6 ละลายอยู่ = 0.10 โมล
ความเข้มข้นของสารละลาย = 0.10 โมล/กิโลกรัม
ถ้าสารละลายเข้มข้น 1.0 โมล/กิโลกรัม จุดเดือดเพิ่มขึ้น 0.51 oC (ดูจากค่า Kb)
สารละลายเข้มข้น 0.10 โมล/กิโลกรัม จุดเดือดเพิ่มขึ้น = 0.051 oC
จุดเดือดของสารละลาย = 100 + 0.051 = 100.051 oC ตอบ
ใช้สูตร ; ΔTb = Kb.m
Tb = จุดเดือดที่เพิ่มขึ้น
Kb = ค่า Kb ของตัวทำละลาย
m = ความเข้มข้นของสารละลาย (mol/Kg)
= 1,000 x W1 / W2 x M
Tb = Kb. m
จากตัวอย่าง ΔTb = 0.51 x 1,000 x 1.8 /100 x 180
= 0.051 oC
จุดเดือดของสารละลาย = 100 + 0.051 = 100.051 oC ตอบ
ในทำนองเดียวกันถ้าเราพิจารณาที่จุดเยือกแข็งของสารละลายก็จะพบว่า ตัวทำละลายแต่ละชนิดมีค่าคงที่ของการลดลงของจุดเยือกแข็ง (Kf) เฉพาะตัว เช่น
|
ตัวทำละลาย
|
จุดเยือกแข็งของตัวทำละลายบริสุทธิ์, oC
|
Kf oC m-1
|
|
Water , H2O
|
0.0
|
1.86
|
|
acetic acid,CH3COOH
|
16.6
|
3.9
|
|
Benzene,C6H6
|
5.5
|
5.12
|
|
Chloroform,CHCl3
|
-63.5
|
4.68
|
|
Nitrobenzene,C6H5NO2
|
5.67
|
8.1
|
ถ้าเตรียมสารละลายจากตัวทำละลายเหล่านี้ให้มีความเข้มข้น 1.0 โมล/กิโลกรัม สารละลายจะมีจุดเยือกแข็งดังนี้
|
ตัวทำละลาย
|
จุดเยือกแข็งของตัวทำละลายบริสุทธิ์, ( ( oC )
|
Kf , oC m-1
|
จุดเยือกแข็งของสารละลายซึ่งเข้มข้น 1.0 โมล/กิโลกรัม
( oC )
|
|
Water
H2O
|
0.0
|
1.86
|
0.0 - 1.86
= - 1.86
|
|
acetic acid
CH3COOH
|
16.6
|
3.9
|
16.6 - 3.9
= 12.70
|
|
Benzene
C6H6
|
5.5
|
5.12
|
5.5 - 5.12
= 0.38
|
|
Chloroform
CHCl3
|
-63.5
|
4.68
|
-63.5 – (+4.68)
= -58.82
|
|
Nitrobenzene
C6H5NO2
|
5.67
|
8.1
|
5.67 – 8.1
= -2.43
|
ตัวอย่าง สารละลายที่เกิดจาก C6H12O6 1.80 กรัม ละลายในน้ำบริสุทธิ์ 100 กรัม สารละลายจะมีจุดเยือกแข็งกี่ oC (Kf ของน้ำ = 1.86 oC m-1)
วิธีทำ จำนวนโมลของ C6H12O6 ; n = W/M = 1.8 / 180 = 0.010 โมล
น้ำบริสุทธิ์ 100 กรัม มี C6H12O6 ละลายอยู่ 0.010 โมล
น้ำบริสุทธิ์ 1,000 กรัม มี C6H12O6 ละลายอยู่ = 0.10 โมล
ความเข้มข้นของสารละลาย = 0.10 โมล/กิโลกรัม สารละลายเข้มข้น 1.0 โมล/กิโลกรัม จุดเยือกแข็งลดลง 1.86 oC
สารละลายเข้มข้น 0.10 โมล/กิโลกรัม จุดเยือกแข็งลดลง = 0.186 oC
จุดเยือกแข็งของสารละลาย = 0 – 0.186 = -0.186 oC ตอบ
ใช้สูตร ; ΔTf = Kf.m
Tf = จุดเดือดที่เพิ่มขึ้น
Kf = ค่า Kf ของตัวทำละลาย
M = ความเข้มข้นของสารละลาย (mol/Kg)
จากตัวอย่าง ΔTf = Kf x 1,000 x W1 / W2 x M
= 1.86 x 1,000 x 1.8 / 100 x 180
= 0.186 oC
จุดเยือกแข็งของสารละลาย = 0 – 0.186 = -0.186 oC ตอบ
เพิ่มเติม ให้พิจารณาลักษณะของการละลายของสารแต่ละชนิดที่แตกต่างกัน บางชนิดละลายโดยไม่แตกตัวเป็นไอออน ในขณะที่บางชนิดมีการแตกตัวเป็นไอออน เช่น
C6H12O6(s) → C6H12O6(aq)
NaCl(s) → Na+(aq) + Cl-(aq)
จะเห็นได้ว่าการละลายของ C6H12O6 ละลายโดยไม่แตกตัวเป็นไอออน ถ้านำ C6H12O6 จำนวน 1 โมล มาละลายน้ำ ในสารละลายจะมีจำนวนโมเลกุลของ
C6H12O6 จำนวน 6.02 x 1023 โมเลกุล หรือจำนวนโมลของอนุภาคยังเป็น 1 โมลตามเดิม
ถ้านำ NaCl จำนวน 1 โมล มาละลายน้ำ ในสารละลายจะมี Na+ และ Cl- ชนิดละ 1 โมล รวมเป็น 2 โมล จำนวน ดังสมการ
NaCl(s) → Na+(aq) + Cl-(aq)
- NaCl 1 โมล มีมวล 58.5 กรัม
- NaCl 1 โมล ขณะเป็นของแข็งประกอบด้วย NaCl จำนวน 6.02 x 1023 หน่วยสูตร
- NaCl 1 โมล หลังการละลายมีการแตกตัวเป็นไอออน ทำให้มี Na+ เกิดขึ้น 1 โมล ( 6.02 x 1023 ไอออน) และมี Cl- เกิดขึ้น 1 โมล (6.02 x 1023 ไอออน)
จำนวนไอออนทั้งหมดมี 2 โมล
- กรณีนี้มีผลให้สารละลาย NaCl ความเข้มข้น 1 โมล/กิโลกรัม (โดยมวล) กลายเป็นสารละลายที่มีความเข้มข้น 2 โมล/กิโลกรัม (โดยจำนวนอนุภาค)
* ถ้าเปรียบเทียบระหว่างสารละลาย C6H12O6 กับสารละลาย NaCl จะมีความเข้มข้น 1 โมล/กิโลกรัม (โดยมวล) เท่ากัน
* ถ้าเปรียบเทียบกันที่จำนวนอนุภาค สารละลาย C6H12O6 จะเข้มข้น 1 โมล/กิโลกรัม แต่สารละลาย NaCl จะเข้มข้น 2 โมล/กิโลกรัม
- การเพิ่มขึ้นของจุดเดือดของสารละลาย C6H12O6 จะเพิ่มขึ้น = 0.51 oC
- การเพิ่มขึ้นของจุดเดือดของสารละลาย NaCl จะเพิ่มขึ้น = 2 x 0.51 oC
- การลดลงของจุดเยือกแข็งของสารละลาย C6H12O6 จะลดลง = 1.86 oC
- การลดลงของจุดเยือกแข็งของสารละลาย NaCl จะลดลง = 2 x1.86 oC
* จะเห็นได้ว่าสารละลาย NaCl ที่มีความเข้มข้น 1 โมล/กิโลกรัม (โดยมวล) จะกลายเป็นสารละลายที่มีความเข้มข้น 2 โมล/กิโลกรัม โดยจำนวนอนุภาค ให้ใช้ข้อสังเกตว่า
สารละลายต่างชนิดที่มีตัวทำละลายเป็นสารเดียวกัน แต่ตัวละลายเป็นสารต่างชนิดกัน จะมีจุดเดือดและจุดเยือกแข็ง (จุดหลอมเหลว) เท่ากันหรือไม่ ให้ดูจากอัตราส่วนระหว่าง
จำนวนอนุภาคของตัวทำละลายต่อจำนวนอนุภาคของตังละลายที่มีอยู่ในสารละลายนั้น ๆ ถ้ามีอัตราส่วนเดียวกันจึงจะมีจะเดือดและจุดเยือกแข็ง (หลอมเหลว) เท่ากัน
(คลิ้ก ชมแอนิเมชันแสดงการละลายที่แตกตัวและไม่แตกตัวเป็นไอออน)
(คลิ้ก ชมแอนิเมชันแสดงการทดลองเหมือนจริงและทำการทดลองเองได้)
แบบฝึกหัด
1. ค่าคงที่ของการเพิ่มขึ้นของจุดเดือด (kb) คืออะไร
2. ค่าคงที่ของการเพิ่มขึ้นของจุดเดือด (kb) ของน้ำ = 0.51 oC mol/kg หมายความว่าอย่างไร
3. ค่าคงที่ของการลดลงของจุดเยือกแข็ง (Kf) คืออะไร
4. ค่าคงที่ของการลดลงของจุดเยือกแข็ง (kf) ของน้ำ = 1.86 oC mol/kg หมายความว่าอย่างไร
5. จงคำนวณหาจุดเดือดและจุดเยือกแข็งของสารละลายที่เปลี่ยนแปลงไปเมื่อเปรียบกับน้ำบริสุทธิ์ ของสารละลายที่เกิดจากกลีเซอรีน (C3H8O3) หนัก 1.00 g ละลายในน้ำ 47.8 g กำหนดค่า Kb ของน้ำ = 0.50 oC/m ; Kf = 1.86 oC/m (ตอบ จุดเดือดเพิ่ม 0.116 oC และ จุดเยือกแข็งลดลง 0.422 oC)
6. จงคำนวณหาจุดเดือดและจุดเยือกแข็งของสารละลายซึ่งมีไอโอดีน ( I2) 92.1 g ละลายในโคโรฟอร์ม (CHCl3) 800.0 g สมมติว่าไอโอดีนไม่ระเหย กำหนดให้ จุดเดือด จุดเยือกแข็ง Kb และ Kf ของคลอโรฟอร์มมีค่า -24 oC, -98 o C , 3.46 o C/m และ 4.68 oC/m ตามลำดับ
7. จงคำนวณหาน้ำหนักของเอทิลีนไกลคอล (C2H6O2) ที่ละลายในน้ำ 2 กิโลกรัม และสารละลายมีจุดเยือกแข็ง -10 °C (มวลโมเลกุลเอทิลีนไกลคอล=62 Kf น้ำ=1.86 °C/m)
8. นำสารอินทรีย์ชนิดหนึ่ง 1.20 กรัม ละลายในเบนซีน 60 กรัม สารละลายนี้มีจุดเดือด 81.06 °C จงคำนวณหามวลโมเลกุลของสารอินทรีย์นี้ (กำหนดให้เบนซีนบริสุทธิ์มีจุดเดือด 80.1 °C และ Kb=2.53 °C/m)
9. เมื่อนำโปรตีนชนิดหนึ่งหนัก 50 กรัม ละลายน้ำจนได้สารละลายปริมาตร 500 cm3 ไปหาจุดเยือกแข็ง อยากทราบว่าสารละลายจะมีจุดเยือกแข็งที่อุณหภูมิเท่าใด(กำหนดมวลโมเลกุลโปรตีน = 4762 Kf น้ำ = 1.86 °C/m และความเข้มข้นสารละลายในหน่วยโมลาร์ เท่ากับความเข้มข้นสารละลายในหน่วยโมแลล)
10. เกลือฟลูออไรด์ของโลหะแอลคาไล 4.0 g ละลายในน้ำ 100 g ได้สารละลายซึ่งมีจุดเยือกแข็ง -1.4 °C จงคำนวณหาสูตรของเกลือนี้ซึ่งแตกตัว 100% ในน้ำ
11. ในช่วงฤดูหนาวของบางประเทศ อุณหภูมิของอากาศจะลดต่ำกว่า 0 °C จึงทำให้น้ำในหม้อน้ำรถยนต์เกิดการแข็งตัว เพื่อแก้ปัญหานี้ได้มีการเติมสารบางชนิดลงไปในหม้อน้ำ เพื่อทำให้สารละลายที่ได้มีจุดเยือกแข็งต่ำกว่า 0 °C
11.1) จงหาจุดเยือกแข็งของสารละลายในหม้อน้ำ ถ้าสารที่เติมลงไปคือ Prestone , C2H4(OH)2 จำนวน 5 กิโลกรัม และในหม้อน้ำรถยนต์มีน้ำอยู่ 12 กิโลกรัม
11.2) ถ้าสารที่เติมคือ methanol, CH3OH จะต้องใช้ CH3OH กี่กิโลกรัม จึงจะให้ผลเช่นเดียวกับการเติม Prestone ในข้อ 11.1 (, Kf น้ำ = 1.86 °C/m)
12. มีสารละลายอยู่ 2 ขวด ขวดที่ 1 ประกอบด้วยสาร x ละลายในตัวทำละลาย A สารละลายนี้มีจุดเยือกแข็ง 2 °C ขวดที่ 2 ประกอบด้วยสาร x ละลายในตัวทำละลาย B โดยที่น้ำหนักสาร x ในขวดที่ 1 และขวดที่ 2 เท่ากัน และตัวทำละลาย A ในขวดที่ 1 และตัวทำละลาย B ในขวดที่ 2 ก็มีน้ำหนักเท่ากันด้วย จงหาจุดเดือดของสารละลายในขวดที่ 2
กำหนดให้ตัวทำละลาย A มีจุดเยือกแข็ง 6 °C และมี Kf = 5 °C/m
กำหนดให้ตัวทำละลาย B มีจุดเดือด 60 °C และมี Kb = 4 °C/m
13. นำตัวถูกละลายชนิดหนึ่งไม่ระเหยและไม่แตกตัว จำนวน 0.10 โมล ละลายในตัวทำละลายจำนวนหนึ่ง สารละลายที่ได้มีจุดเดือด 72 °C เมื่อตั้งสารละลายทิ้งไว้นาน ๆ ทำให้ตัวทำละลายระเหยไป หลังจากนั้นนำสารละลายมาหาจุดเดือดพบว่าจุดเดือดของสารละลายคือ 72.2 °C จงคำนวณหาน้ำหนักของตัวทำละลายที่ระเหยไป (จุดเดือดของตัวทำละลายบริสุทธิ์ = 70 °C, Kb ของตัวทำละลาย = 2 °C/m)
14. สารละลายที่มีกลูโคส 0.1 โมล และ Pb(NO3)2 0.1 โมล ในน้ำ 500 กรัม จะมีจุดเยือกแข็งเท่าใด ถ้า Pb(NO3)2 ในสารละลายแตกตัวได้ 100 % และไม่มีแรงดึงดูดระหว่างไอออน (Kf น้ำ = 1.86 °C/m)
15. เอทิลีนไกลคอลเป็นสารที่ใช้เป็นสารป้องกันการแข็งตัว (antifreeze) ในหม้อน้ำรถยนต์ มีสมบัติละลายน้ำได้ดีและระเหยยาก มีจุดเดือด 197 °C กำหนดมวลโมเลกุลเอทิลีนไกลคอล = 62.01 Kb น้ำ = 0.52 °C/m Kf น้ำ = 1.86 °C/m จงคำนวณจุดเยือกแข็งของสารละลายที่เกิดจากเอทิลีนไกลคอล 651 g ในน้ำ 2505 g
16. ลูกเหม็นมีจุดเยือกแข็งที่อุณหภูมิ 178.4 องศาเซลเซียส มี Kf = 40.0 ๐ C/m จงหาว่าจุดเยือกแข็งของสารละลายจะลดลงเท่าใด ถ้ามีสาร A (Mw = 125 g/mol) 1.50 กรัม ละลายอยู่ในลูกเหม็น 35.0 กรัม(13.7 ๐ C)
17. สารละลายที่มีตัวถูกละลายชนิดไม่แตกตัว จำนวน 4.5 กรัม ละลายในน้ำ 125 กรัม เกิดการแข็งตัวที่อุณหภูมิ –0.372 ๐ C จงคำนวณน้ำหนักโมเลกุลของตัวถูกละลายนี้ กำหนดให้ Kf ของน้ำ = 1.86๐ C/m
18. ละลายสารประกอบเกลือของโพแทสเซียม (KX) จำนวน 8.00 กรัม ในน้ำ 100 กรัม สารละลายนี้แข็งตัวที่ –1.25 ๐ C จงหาว่า X คือธาตุใดของหมู่ 7A ( Br)
Appendix
A. Calculate the molality, freezing point, and boiling point for each of the following water solutions of nonionizing solutes: ( จงคำนวณหาความเข้มข้นของสารละลายต่อไปนี้ในหน่วยโมล/กิโลกรัม รวมทั้งจุดเยือกแข็งและจุดเดือดด้วย สารละลายเหล่านี้มีน้ำเป็นตัวทำละลาย)
1. 144 g of C6H12O6 dissolved in 1000 g of H2O (ใช้ C6H12O6 144 g ละลายในน้ำ 1,000 กรัม)
2. 48 g of CH3OH dissolved in 200 g of H2O (ใช้ CH3OH 48 g ละลายในน้ำ 200 กรัม)
3. 184 g of C2H5OH dissolved in 400 g of H2O (ใช้ C2H5OH 184 g ละลายในน้ำ 400 กรัม)
4. 600 g of C3H7OH dissolved in 600 g of H2O C3H7OH (ใช้ C3H7OH 600 g ละลายในน้ำ 600 กรัม)
5. 100 g of of C2H6O2 dissolved in 200 g of H2O (ใช้ C2H6O2 100 g ละลายในน้ำ 200 กรัม)
B. Calculate the molality of a water solution if the freezing point is: (จงหาความเข้มข้นในหน่วย โมล/กิโลกรัม ของสารละลายซึ่งมีน้ำเป็นตัวทำละลาย และมีจุดเยือกแข็งตามที่กำหนด)
1. -9.3°C
2. -27.9°C
3. -7.44°C
C. Calculate the molality of a water solution if the boiling point is: (จงคำนวณหาความเข้มข้นในหน่วยโมล/กิโลกรัม ของสารละลายซึ่งมีน้ำเป็นตัวทำละลายและมีจุดเดือดตามที่กำหนด)
1. 103.12°C
2. 108. 32°C
D. Solve the following Problems
1. What is the boiling point of a solution made by dissolving 31 g of NaCl in 559 g of water?
(Assume 100% ionization of NaCl.) (สารละลายที่เกิดจาก NaCl 31 กรัม ในน้ำ 559 กรัม สารละลายจะมีจุดเดือดเท่าไร)
2. Calculate the freezing point of an a nonionizing antifreeze solution containing 388g ethylene glycol,
C2H6O2 , and 409 g of water. (ใช้เอทิลีนไกลคอล C2H6O2 388 กรัม ละลายน้ำ 409 กรัม โดยการละลายของเอทิลีนไกลคอลไม่แตกตัวเป็นไอออน สารละลายจะมีจุดเยือกแข็งเท่าไร)
3. Calculate the boiling point of an ionic solution containing 29.7 g Na2SO4 and 84.4 g water. (Assume 100% ionization.) (สารละลายที่เกิดจาก Na2SO4 29.7 g ละลายในน้ำ 84.4 g โดยการละลายของ Na2SO4 มีการแตกตัว 100 % สารละลายจะมีจุดเดือดเท่าไร)
4. What is the molecular mass of a substance if 22.5 g dissolved in 250 g of water produces a solution whose freezing point is -0.930°C? (สารชนิดหนึ่งหนัก 22.5 g นำมาละลายในน้ำ 250 g สารละลายที่ได้มีจุดเยือกแข็ง -0.930°C สารดังกล่าวนี้มีมวลโมเลกุลเท่าไร)
5. If 4.18 g of a nonionic solute is dissolved in 36.30 g of benzene, C6H6 , the freezing point is 2.70 °C. Find the molar mass of this solute. The freezing point of benzene is 5.53 °C and the Kf is 5.12 °C /m. (นำสารซึ่งไม่แตกตัวเป็นไอออนจำนวน 4.18 g ละลายในเบนซีน , C6H6 36.30 g ได้สารละลายที่มีจุดเยือกแข็ง 2.70 °C สารดังกล่าวนี้มีมวลโมเลกุลเท่าไร ถ้าจุดเยื่อกแข็งของเบนซีนบริสุทธิ์คือ 5.53 °C และ Kf = 5.12 °C /m.)
6. Calculate the freezing of each of the following solution (จงหาจุดเยือกแข็งและจุดเดือดของสารละลายต่อไปนี้)
6.1) 0.17 m glycerol,C3H8O3 (Kf of water = 1.86 oC/m) (สารละลายกลีเซอรอล ความเข้มข้น 0.17 โมแลล)
6.2) 1.92 mol of naphthalene , C10H8, in 16.8 mol of chloroform , CH3Cl (Kf of CH3Cl = 4.68 oC/m)
(สารละลายที่เกิดจากแนพทาลีน ,C10H8 1.92 โมล ละลายในคลอโรฟอร์ม , CH3Cl 16.8 โมล)
6.3) 5.44 g of KBr and 6.35 g glucose , C6H12O6 , in 200 g of water (Kf of water = 1.86 oC/m)
(สารละลายที่เกิดจาก KBr 5.44 กรัม และ C6H12O6 6.35 กรัม ละลายอยู่ในน้ำ 200 กรัม)
7. calculate of the boiling points of each of the following solutions (จงหาจุดเดือดของสารละลายต่อไปนี้)
7.1) 0.60 m glucose in ethanol (Kb of ethanol = 1.99 oC.m-1) (สารละลายกลูโคสความเข้มข้น 0.60 โมแลล ในเอทานอล)
7.2) 16.0 g of C10H22 in 420 g CHCl3 (Kb of CHCl3 = 5.24 oC.m-1) (สารละลายที่เกิดจาก C10H22 จำนวน 16.0 กรัม ละลายอยู่ใน CHCl3 420 กรัม)
7.3) 0.40 mol ethylene glycol and 0.12 mol KBr in 140 g H2O (Kb of water = 0.51 oC.m-1) (สารละลายที่เกิดจากเอทิลีนไกลคอล 0.40 โมล และ KBr อีก 0.12 โมล ละลายอยู่ในน้ำ 140 กรัม)
8. Adrenaline is the hormone that trigger release of extra glucose molecule in time of stress of emergency. A solution of 0.64 g of adrenaline in 36.0 g of CCl4 cause an elevation of 0.49 oC in the boiling point. What is the molar mass of adrenaline ? (Kb of CCl4 is 5.00 oC/m) (ฮอร์โมนอะดรีนาลีน เป็นฮอร์โมนในภาวะฉุกเฉินของร่างกาย ถ้าฮอร์โมนชนิดนี้ 0.64 กรัม ละลายใน CCl4 36.0 g ทีผลให้จุดเดือดเปลี่ยนไป 0.49 oC อยากทราบว่าอะดรีนาลีนมีมวลโมเลกุลเท่าไร (Kb ของ CCl4 is 5.00 oC/m)
9. Laural alcohol is obtained from coconut oil and is use to make detergents. A solution of laural alcohol in 0.100 kg of benzene freezes at 4.0 oC . What is the molar mass of the subatance ? (Kf of benzene = 5.12 oC/m) (ลอรอลแอลกอฮอล์ผลิตจากน้ำมันมะพร้าวนำมาใช้ในการผลิตผงซักฟอก นำแอลกอฮอล์ชนิดนี้ไปละลายในเบนซีน 0.100 kg สารละลายมีจุดเยือกแข็ง 4.0 oC แอลกอฮอล์ดังกล่าวมีมวลโมเลกุลเท่าไร (Kf ของ benzene = 5.12 oC/m)
10. Which solution would give the larger freezing-point lowering, (สารละลายใดมีจุดเยือกแข็งต่ำสุด)
a) 0.030 m solution of NaCl or b) 0.02 m solution of K2SO4 ?
11. The cooling system of an automobiles is filled with a solution formed by mixing equal volumes of water. (density = 1.00 g/cm3) ang ethylene glycol, C2H6O2 (density = 1.12 g/cm3) Estimate the freezing point and boiling point of the mixture. (ระบบระบายความร้อนของรถยนต์เติมสารละลายที่ประกอบด้วยส่วนผสมระหว่างน้ำ (ความหนาแน่น 1.00 g/cm3) แลแอทิลีนไกลคอล C2H6O2 (ความหนาแน่น = 1.12 g/cm3) จงหาจุดเยือกแข็งและจุดเดือดของสารละลายนี้)
12. Carbondisulfide, CS2 , boil at 46.30 oC and has density of 1.261 g/cm3 (คาร์บอนไดซัลไฟด์ CS2 มีจุดเดือด 46.30 oC และมีความหนาแน่น 1.261 g/cm3 )
a) When 0.250 mol of an non-dissociating solute is dissoled in 400 cm3 of CS2 , the solution boils at 47.46 oC . What is the molal boiling-point elevation constant of CS2 ? (เมื่อใช้ตัวละลายที่ไม่แตกตัวเป็นไอออนจำนวน 0.250 mol ละลายในคาร์บอนไดซัลไฟด์ 400 cm3 สารละลายที่ได้มีจุดเดือด 47.46 oC ค่า Kb ของ CS2 เป็นเท่าไร)
b)
Content's Picture

Size : 30.65 KBs
Upload : 2013-08-05 04:45:13
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|