1. เพราะ HCl มีแรงลอนดอนต่ำสุด 2. เพราะ HCl มีแรงลอนดอนสูงสุด
3.เพราะ
HCl มีแรงแวนเดอร์วาลส์ต่ำสุด 4.เพราะ HCl ไม่เกิดพันธะไฮโดรเจน
2. (Ent.42
มี.ค.) กำหนดสมบัติของสารประกอบ A
B C และ D
ดังนี้
ก. A
C และ d ละลายน้ำ ข. B
C และ D
เป็นสารประกอบโคเวเลนต์
ค. B เป็นโมเลกุลไม่มีขั้ว ง. D เกิดพันธะไฮโดรเจนกับน้ำ
การเรียงลำดับจุดเดือดข้อใดถูกต้อง
1. A > B >C > D 2.
A > C > B > D
3. A > D > C > B 4.
D > A > C > B
3. (Ent.42 ต.ค.) สารประกอบคู่ใดที่ไม่ได้เรียงลำดับความแรงขั้วจากสูงไปต่ำ
1. HBr
HCl 2. H2O H2S 3.
NCl3 BCl3 4. IF
BrCl
4. (Ent.43 ต.ค.) กำหนดค่าอิเล็กโตรเนกาติวิตี (EN) ของธาตุบางชนิด
|
อะตอม
|
ค่า
EN
|
|
Si
|
1.90
|
|
H
|
2.20
|
|
S
|
2.58
|
|
Br
|
2.96
|
|
Cl
|
3.16
|
สภาพขั้วของพันธะโคเวเลนต์ต่อไปนี้
ข้อใดเรียงลำดับจากมากไปน้อยได้ถูกต้อง
1. H-Cl
H-Br Si-S Si-H 2. H-Cl
Si-S Si-H H-Br
3. H-Cl
H-Br Si-H Si-H 4. Si-H
Si-H H-Br H-Cl
5. (Ent.44 มี.ค.)
การกล่าวถึง แรงระหว่างโมเลกุลข้อใดผิด
1. แรงแวนเดอร์วาลส์ระหว่างโมเลกุลของ H2O มีค่ามากกว่าระหว่างโมเลกุลของ NH3
2. แรงลอนดอนระหว่างโมเลกุลของ SiH4 มีค่ามากกว่าระหว่างโมเลกุลของ CH4
3. พันธะไฮโดรเจนใน C2H5OH แข็งแรงมากกว่าใน C2H5SH
4. พันธะไฮโดรเจนใน CH3F แข็งแรงมากกว่าใน CH3OH
6. (Ent.47 มี..ค.) สารในข้อใดที่แรงยึดเหนี่ยวระหว่างโมเลกุลเป็นพันธะไฮโดรเจนทุกสาร
1. H2NNH2 CH3F H2S CH4 2. CHCl3 CH3COCH3 SiH4 HCl
3. CH3NH2 HCOOH
HF H2O2 4. NH3 H2O H2S H2CO3
7. (Ent.47 ต.ค.) พิจารณาสมบัติของธาตุสมมติต่อไปนี้
|
ธาตุ
|
สมบัติของธาตุ
|
|
A
|
มีขนาดเล็กที่สุดในตารางธาตุ
|
|
B
|
อยู่ในคาบที่ 3 และหมู่เดียวกับ
|
|
C
|
มีค่าอิเล็กโตรเนกาติวิตีมากที่สุด
|
|
D
|
อยู่ในคาบเดียวกับ
มีเลขอะตอมน้อยกว่า O แต่มี IE1 มากกว่า
|
ข้อใดผิด
1. AC มีจุดเดือดสูงกว่า DA3
2. แรงยึดเหนี่ยวระหว่างโมเลกุลของ DA3 มากกว่าของ A2B
3. DC3 และ BC3 มีจำนวนอิเล็กตรอนคู่โดดเดี่ยวของอะตอมกลางเท่ากัน
4. A2B และ DA3 มีรูปร่างโมเลกุลเป็นมุมงอและสามเหลี่ยมแบนราบตามลำดับ
8. (Ent.47 ต.ค.) แรงยึดเหนี่ยวระหว่างโมเลกุลแบบพันธะไฮโดรเจนข้อใดผิด
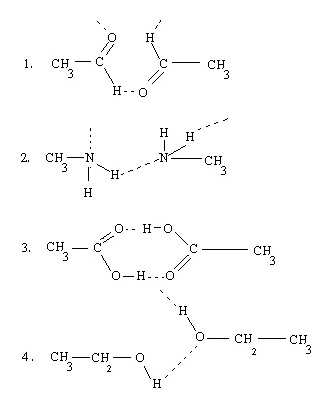
9. (Ent.47 ต.ค.) ข้อใดที่โมเลกุลไม่มีขั้วทั้งหมด
1. CH4 NH3 CHCl3 2. CCl4 SF6 PCl5
3. BF3 PF3 NH3 4. PCl5 CH2Cl2 CCl4
10. (A-net.48) พันธะเคมีในสารต่อไปนี้ข้อใดถูก
|
|
พันธะ
|
|
|
ไอออนิก
|
โคเวเลนต์
|
โคออร์ดิเนตโคเวเลนต์
|
ไฮโดรเจนระหว่างโมเลกุล
|
|
1.
|
SiCl4
|
XeF4
|
NH4+
|
HF
|
|
2.
|
KBr
|
Cl2O
|
PH3
|
H2S
|
|
3.
|
SF6
|
PCl5
|
SO2
|
H2O
|
|
4.
|
MgO
|
BF3
|
O3
|
NH3
|
11. (เคมีโอลิมปิค 47) สารในข้อใดมีจุดหลอมเหลวสูง ไม่นำไฟฟ้าในสภาวะของแข็งและไม่ละลายน้ำ
1. LiF 2. Al2O3 3. Ni 4. SiH4
12. (เคมีโอลิมปิค 47) ข้อใดถูกต้องเกี่ยวกับสมบัติของสาร
1. แก๊ส F2 สามารถทำให้เป็นของเหลวที่อุณหภูมิต่ำและความดันสูง เนื่องจากอะตอมฟลูออรีนมีค่าอิเล็กโตร
เนกาติวิตีสูง ทำให้เกิดพันธะไฮโดรเจนระหว่างโมเลกุลได้
2. โมเลกุล Br2 เป็นของเหลว ในขณะที่โมเลกุล
Cl2 เป็นแก๊ส เนื่องมาจากโมเลกุล Br2 มีขนาดใหญ่กว่า
ทำให้เกิดแรงลอนดอนระหว่างโมเลกุลได้ง่ายกว่า
3. แอมโมเนีย (NH3) มีจุดเดือดสูงกว่าน้ำ
(H2O)
เนื่องจากแอมโมเนียมีไฮโดรเจน 3
อะตอมต่อโมเลกุล น้ำ
มีไฮโดรเจน 2
อะตอมต่อโมเลกุล
ดังนั้นพันธะไฮโดรเจนของแอมโมเนียจึงมีค่ามากกว่าน้ำ
4. HI มีจุดเดือดต่ำกว่า
HBr เนื่องจากระหว่างโมเลกุลของ HI มีแรงแวนเดอร์วาลส์ต่ำกว่า HBr
13. (เคมีโอลิมปิค 46) ถ้าไม่นับไฮโดรเจน โมเลกุลในข้อใดที่เป็นไปตามกฎออกเตตและมีขั้ว
ก. SiH4 ข. ClF3 ค. SCl2 ง. CH2O
1. ก ค ง 2. ข ค ง 3. ข ค 4. ค ง
14 (เคมีโอลิมปิค 46) พิจารณาสารประกอบต่อไปนี้ สารใดน่าจะไม่มีแรงยึดเหนี่ยวประเภท พันธะไฮโดรเจน
ก. H2O ข. MaOH ค.
CH3OH ง. HI
1. ก ข 2. ข ค 3. ก ค 4. ข ง
15. (เคมีโอลิมปิค 44) โมเลกุลต่อไปนี้ข้อใดเป็นโมเลกุลที่มีสภาพขั้วของโมเลกุลเป็นชนิดเดียวกัน
1. PCl3 BBr3 PCl5 2.
CO2 GeBr4 PBr2Cl2
3. BrCl3 CS2 OF2 4.
AsF5 SO2 XeO3
16. (เคมีโอลิมปิค 43) พิจารณาข้อความต่อไปนี้ข้อใดถูก
1. NCl3 เป็นโมเลกุลมีขั้ว รูปร่างโมเลกุลเป็นสามเหลี่ยมแบนราบ
2. PBr3 และ BCl3 มีรูปร่างโมเลกุลเหมือนกันและเป็นโมเลกุลมีขั้ว
3. CS2 เป็นโมเลกุลไม่มีขั้ว รูปร่างโมเลกุลเป็นเส้นตรง
4. SCl2 และ SCO
เป็นโมเลกุลมีขั้ว
รูปร่างโมเลกุลเป็นเส้นตรง
17. (เคมีโอลิมปิค 43) ถ้าแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว A มีค่ามากกว่าแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว B สมบัติข้อใดต่อไปนี้ที่ของเหลว A มีค่าน้อยกว่าของของเหลว
B
1. จุดเดือดปกติ
2. อุณหภูมิที่ทำให้ของเหลวมีความดันไอเท่ากับ 100
mmHg
3. ความร้อนแฝงของการกลายเป็นไอ
4. ความดันไอที่อุณหภูมิห้อง
18. (เคมีโอลิมปิค 43) มีของเหลว 4
ชนิด คือ A
B C และ D พบว่า A ไม่ละลายใน B
และ C ไม่ละลายใน D
ส่วน A และ D ละลายซึ่งกันและกันได้ดี
สารชุดใดเป็นไปได้มากที่สุด
|
|
A
|
B
|
C
|
D
|
|
1.
|
CS2
|
H2O
|
CO2
|
CCl4
|
|
2.
|
H2O
|
C6H6
|
Br2
|
CHCl3
|
|
3.
|
H2O
|
C6H14
|
C2H5OC2H5
|
CH3COOH
|
|
4.
|
C6H14
|
CH3COOH
|
NCl3
|
C2H5OH
|
19. (เคมีโอลิมปิค 43) ข้อใดเป็นโมเลกุลที่เกิดจากพันธะโคเวเลนต์มีขั้วทั้งหมด แต่โมเลกุลไม่มีขั้ว
1. NCl3 BCl3 CS2 2.
SO2 AsCl5 SiH4
3. PCl3 CH4 CO2 4.
BeCl2 PCl5 SF6
20. Which
of the following is a nonpolar molecule? (Ans.b) (สารในข้อใดโมเลกุลไม่มีขั้ว)
a) BCl3 b) PCl3 c) H2O d) CH2Cl2 e) NO
21. Which
of the following is a polar molecule? (Ans.b) (สารในข้อใดโมเลกุลมีขั้ว)
a) BrF5 b) XeF4 c) SF6 d) XeF2 e) CCl4
22.
Consider the following molecules and select those that are nonpolar.
(Ans.b)
(จงพิจารณาสารที่กำหนดให้ต่อไปนี้ว่าชนิดใดโมเลกุลไม่มีขั้ว)
1) XeF4 2) SF4 3)
SiF4
a) 3 only b) 1 and 2 c) 2 only d) 1 only e) 1 and 3
23.
Consider the following molecules and select those that are nonpolar. (Ans.c)
(จงพิจารณาสารที่กำหนดให้ต่อไปนี้ว่าชนิดใดโมเลกุลไม่มีขั้ว)
1) BF3 2) PH3 3) SO3 4) ClF3
a) 2 and 3 b) 1 and 2 c) 1 and 3 d) 2 and 4 e) 3 and 4
24.
Consider the following molecules and select those that are nonpolar. (Ans.c)
(จงพิจารณาสารที่กำหนดให้ต่อไปนี้ว่าชนิดใดโมเลกุลไม่มีขั้ว)
1) CO 2) CO2 3) SO2 4) SO3
a) 2 only b) 1 only c) 2 and 4 d) 4 only e) 1 and 3
25. Which of the following has a dipole moment? (Ans.c)
(สารในข้อใดมีแรงยึดเหนี่ยวระหว่างโมเลกุลเป็นแรงระหว่างขั้ว)
a)
BF3 b)
CO2 c) SO2 d) CO2 ,BF3 e) BF3
, SO2
26. Is the PF3 molecule polar, or is
it nonpolar? Explain. (PF3
เป็นโมเลกุลมีขั้วหรือไม่เพราะเหตุใด)
27. Which of the
following bonds is most polar? (พันธะในข้อใดมีขั้วมากที่สุด)
a) N
– Cl b) C – N c)
S – S d) Br – Br e) S – O
28. Which
of the following is a polar species?
(สารในข้อใดเป็นชนิดโมเลกุลมีขั้ว)
a) CO2 b) PCl5 c) ICl2– d) TeCl4 e) CCl4
29. Draw the Lewis structure · Determine the
shape around the central atom · State whether
the molecule is polar or non-polar (จงเขียนสูตรโครงสร้างลิวอิสของสารแต่ละสาร
แล้วบอกรูปร่างโมเลกุล
และตัดสินว่าเป็นโมเลกุลมีขั้วหรือไม่มีขั้ว)
|
Substants
(สารที่กำหนด)
|
Lewis strucyure
(สูตรโครงสร้างลิวอิส)
|
shape around
the central atom
(รูปร่างโมเลกุล)
|
polar or
non-polar
(มีขั้วหรือไม่มีขั้ว)
|
|
CH3F
|
|
|
|
|
IF3
|
|
|
|
|
AsF5
|
|
|
|
|
OF2
|
|
|
|
|
N2H2
|
|
|
|
|
N2O
|
|
|
|
|
N2O4
|
|
|
|
|
C6H6
|
|
|
|
|
CH3I
|
|
|
|
|
C2H6
|
|
|
|
|
C2Cl2
|
|
|
|
|
COCl2
|
|
|
|
|
SCN-
|
|
|
|
|
CH3NH2
|
|
|
|
|
HCOOH
|
|
|
|
|
AsF3
|
|
|
|
|
H2C2O4
|
|
|
|
|
SF2
|
|
|
|
|
SF4
|
|
|
|
|
C2F4
|
|
|
|
|
H2O2
|
|
|
|
|
C2H5OH
|
|
|
|
|
ClO3-
|
|
|
|
|
CO
|
|
|
|
|
CHCl3
|
|
|
|