กรด-เบส ตอนที่ 5 การไทรเทรตกรด-เบส
กรด-เบส (Acid-Base)
ตอนที่ 5 การไทเทรตกรด เบส (acid-base
titration)
เป็นกระบวนการที่สำคัญมากกระบวนการหนึ่งสำหรับการวิเคราะห์เชิงปริมาณ (quantity analysis) ของสารเคมี
ต่าง ๆ
ที่ทราบชนิดอยู่ก่อนแล้วแต่ยังไม่ทราบว่ามีปริมาณมากหรือน้อยเพียงใด เช่น
เราทราบว่ามีกรดฟอร์มิก (HCOOH) อยุ่ในมดแดง แต่ไม่ทราบปริมาณว่ามีเท่าไร
กระบวนการไทเทรตจะทำให้ทราบปริมาณของกรดฟอร์มิกที่มีอยู่ในมดแดงได้ (ยังมีกระบวนการวิเคราะห์อีกแบบหนึ่งเรียกว่าการวิเคราะห์เชิงคุณภาพ
, quality analysis การวิเคราะห์ชนิดนี้เป็นการวิเคราะห์เพื่อหาชนิดของสารที่มีอยู่ในสิ่งที่ต้องการวิเคราะห์
เช่น เมื่อค้นพบวัตถุชนิดใหม่ไม่ทราบว่าประกอบด้วยสารใดบ้าง
จึงวิเคราะห์เพื่อหาชนิดของสารที่เป็นส่วนประกอบในวัตถุนั้น
การวิเคราะห์ลักษณะนี้เป็นการวิเคราะห์เชิงคุณภาพ)
กระบวนการไทเทรตใช้กับสารเคมีต่าง ๆ ได้หลากหลาย
แต่ในที่นี้จะกล่าวถึงโดยจำกัดอยู่กลุ่มของสารจำพวกกรดและเบสเท่านั้น ปฏิกิริยาที่เกิดขึ้นในกระบวกการไทเทรตระหว่างกรด-เบส ก็คือปฏิกิริยาระหว่างกรดกับเบสในรูปแบบต่าง
ๆ ประกอบด้วย กรดแก่ + เบสแก่ หรือกรดแก่ + เบสอ่อน หรือ กรดอ่อน + เบสแก่ ผลิตภัณฑ์ทีได้จึงเป็นเกลือ + น้ำ แต่เกลืออาจเป็นกลาง หรือเป็นกรดอ่อน หรือเป็นเบสอ่อน ขึ้นอยู่กับชนิดของกรดหรือเบสที่ไทเทรตกัน
สารเคมีที่เกี่ยวข้องในการไทเทรตกรด-เบส
ประกอบด้วย
1.
สารละลายที่ต้องการวิเคราะห์หรือสารละลายตัวอย่าง (Sample solution)
คือสารละลายที่ทราบชนิดแต่ไม่ทราบปริมาณ และต้องการวิเคราะห์เพื่อหาปริมาณของสารนั้น
ในที่นี้อาจเป็นสารละลายกรดหรือสารละลายเบสชนิดใดชนิดหนึ่ง
2. สารละลายมาตรฐาน (Standard
Solution) คือสารละลายที่ทราบทั้งชนิดและความเข้มข้น เป็นสารละลายที่ต้องเตรียมขึ้นมาก่อน เพื่อนำไปทำปฏิกิริยากับสารที่ต้องการวิเคราะห์ในการไทเทรต
เพื่อนำผลของปฎิกิริยามาคำนวณหาปริมาณของของสารที่ต้องการวิเคราะห์ ในที่นี้สารละลายมาตรฐานอาจเป็นสารละลายกรดหรือสารละลายเบสก็ได้
แต่ต้องทราบชนิดของกรดหรือเบสและความเข้มข้น
ถ้าสารละลายตัวอย่างเป็นสารละลายกรด สารละลายมาตรฐานก็จะต้องเป็นสารละลายเบส
ถ้าสารละลายตัวอย่างเป็นสารละลายเบส สารละลายมาตรฐานก็จะต้องเป็นสารละลายกรด
3. อินดิเคเตอร์สำหรับกรด-เบส (Acid-base
indicator) ใช้เพื่อเป็นข้อสังเกตว่าจะยุติการไทเทรต
ณ เวลาใด โดยดูจากการเปลี่ยนสีของอินดิเคเตอร์ที่เกิดขึ้นระหว่างการไทเทรต
สารที่มีสมบัติเป็นอินดิเคเตอร์สำหรับกรด-เบส
เป็นสารที่มีโครงสร้างโมเลกุลซับซ้อนและมีสมบัติเป็นกรดอ่อน เช่น
ฟีนอล์ทาลีน
มีโครงสร้างโมเลกุลดังนี้
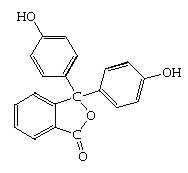 เมื่อเป็นสารละลายจะมีภาวะสมดุล ดังนี้ เมื่อเป็นสารละลายจะมีภาวะสมดุล ดังนี้
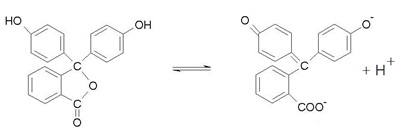
รูปโมเลกุล
(กรดอ่อน) รูปไอออน (คู่เบส)
ไม่มีสี สีชมพู
เมื่อหยดฟีนอล์ฟทาลีนลงในสารละลายกรดจะไม่มีสี เพราะสารละลายกรดมี H+ มาก
จึงทำให้สมดุลของฟีนอล์ฟทาลีนปรับตัวมาทางซ้าย ทำให้รูปไอออนหรือคู่เบสลดลง รูปโมเลกุลมีมากขึ้น จึงทำให้สีชมพูจางลงจนกลายเป็นไม่มีสี
เมื่อหยดฟีนอล์ฟทาลีนลงในสารละลายเบสจะมีสีชมพู เพราะสารละลายเบสมี OH- มาก
จึงรวมตัวกับ H+
จึงทำให้ H+
ซึ่งอยู่ทางขวาของสมดุลลดลง
สมดุลของฟีนอล์ฟทาลีนปรับตัวมาทางขวา
ทำให้รูปไอออนหรือคู่เบสเพิ่มขึ้น
รูปโมเลกุลลดลง
จึงทำให้เปลี่ยนจากไม่มีสีเป็นสีชมพู
ดังรูป
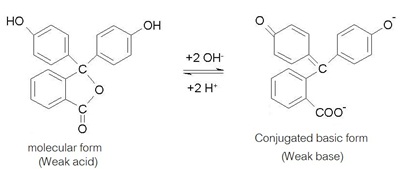
การเปลี่ยนสีของอินดิเคเตอร์ชนิดอื่น
ๆ มีหลักการเดียวกันนี้
สมบัติในการเปลี่ยนสีของอินดิเคเตอร์แต่ละชนิดเป็นสมบัติเฉพาะตัวที่จะเปลี่ยนจากสีหนึ่งไปเป็นอีกสีหนึ่งในช่วง pH ต่าง ๆ กัน กรณีของพีนอล์ฟทาลีน ช่วงการเปลี่ยนสีจะอยู่ระหว่างช่วง pH 8.3 ถึง 10.4
หมายความว่าถ้า
pH ต่ำกว่า 8.3
จะไม่มีสี
pH 8.3 จะเริ่มเปลี่ยนเป็นสีชมพูอ่อน
ๆ และค่อย ๆ เข้มข้นเมื่อ pH
เพิ่มขึ้น และจะเข้มเต็มที่เมื่อ pH = 10.4
pH 10.4 ขึ้นไปความเข้มจะคงเดิม
เนื่องจากโมเลกุลของอินดิเคเตอร์เป็นโมเลกุลที่มีโครงสร้างซับซ้อน จึงใช้สูตร HIn แทนสูตรโมเลกุลของอินดิเค
เตอร์ชนิดต่าง ๆ
HIn เป็นสูตรโมเลกุลของอินดิเคเตอร์ (Acid form)
In- เป็นคู่เบสของอินดิเคเตอร์แต่ละชนิด
(base form)
ภาวะสมดุลของอินดิเคเตอร์
เมื่อเขียนแสดงด้วยสูตร HIn แทนสูตรจริงจะเป็นดังนี้
HIn (aq) + H2O (l) ↔ H3O+ (aq)
+ In- (aq)
ถ้า HIn หมายถึงฟีนอล์ฟทาลีน เมื่ออยู่ในรูป HIn จะไม่มีสี
เมื่อยู่ในรูป In- จะมีสีชมพู เป็นดังรูป

- เมื่อเติมกรดหรือหยดลงไปในสารละลายกรด
(มี H3O+ มาก) ทำให้สมดุลเลื่อนมาทางซ้าย
หรือปฏิกิริยาย้อนกลับจะเกิดได้มากขึ้น ทำให้ in- ลดลง
แต่มี HIn มากขึ้น ทำให้สีชมพูจงลงจนกลายเป็นไม่มีสี
- เมื่อเติมเบสหรือหยดลงไปในสารละลายเบส
(มี OH- มาก) OH-
ทำให้สมดุลเลื่อนมาทางขวา หรือปฏิกิริยาไปข้างหน้าจะเกิดได้มากขึ้น
ทำให้ HIn ลดลง แต่มี in- มากขึ้น ทำให้มีสีชมพูเกิดขึ้นและค่อย ๆ
เข้มขึ้นจนเข้มคงที่
- อินดิเคเตอร์ต่าง
ๆ ก็จะมีรูปแบบในการเปลี่ยนสีเมื่ออยู่ในสารละลายกรดหรือเบสทำนองเดียวกันนี้ แต่การเปลี่ยนสีจะอยู่ในช่วง
pH ต่าง ๆ กัน ดังตัวอย่างในตาราง
|
Indicator
(ชนิดของอิดิเคเตอร์)
|
pH
Range
(ช่วง pH ที่เปลี่ยนสี)
|
Color (สี)
|
|
Acid(ในสารละลายกรด)
|
Base(ในสารละลายเบส)
|
|
Thymol
Blue
|
1.2-2.8
|
red
|
yellow
|
|
Methyl
orange
|
2.9-4.0
|
red
|
yellow
|
|
Methyl
red
|
4.4-6.2
|
red
|
yellow
|
|
Litmus
|
4.5-8.3
|
red
|
blue
|
|
Neutral
red
|
6.8-8.0
|
red
|
yellow
|
|
Phenolphthalein
|
8.0-10.4
|
colorless
|
red
|
(คลิ้ก
ชม pH range for indicator)
จากข้อมูลในตารางจะเห็นได้ว่าช่วง pH ในการเปลี่ยนสีของอินดิเคเตอร์แต่ละชนิดจะอยู่ในช่วง pH ต่าง ๆ กัน
การนำอินดิเคเตอร์ไปใช้เพื่อการไทเทรตกรด-เบส จึงต้องเลือกอินดิเคเตอร์ให้เหมาะสม มีหลักการดังนี้
ถ้าเป็นการไทเทรตระหว่าง กรดแก่ + เบสแก่ จุดสมมูลจะมี pH = 7 ควรเลือกอินดิเคเตอร์ที่มีการเปลี่ยนสีในช่วง
pH = 7
หรือใกล้เคียงและสังเกตการเปลี่ยนสีได้ง่าย เช่น Litmus Neutral
red
ถ้าเป็นการไทเทรตระหว่าง กรดแก่ + เบสอ่อน จุดสมมูลจะมี pH <
7 ควรเลือกอินดิเคเตอร์ที่มีการเปลี่ยนสีในช่วง
pH < 7 เช่น Methyl
red Methyl orange Thymol Blue
ถ้าเป็นการไทเทรตระหว่าง กรดอ่อน + เบสแก่ จุดสมมูลจะมี pH >7 ควรเลือกอินดิเคเตอร์ที่มีการเปลี่ยนสีในช่วง
pH > 7 เช่น Phenolphthalein
ภาวะสำคัญที่เกิดขึ้นในการไทเทรตกรด-เบส
ในการไทเทรตระหว่างกรด-เบสต่าง ๆ นั้น ภาวะสำคัญของการไทเทรตคือขณะที่กรด-เบสทำปฏิกิริยากันพอดี
เรียกว่าจุดสมมูลหรือจุดสะเทิน (equivalent point) แต่เราสังเกตโดยตรงไม่ได้ จึงต้องสังเกตจากการเปลี่ยนสีของอินดิเคเตอร์ เรียกว่าจุดยุติ (end point) ซึ่งอาจไม่ตรงกับจุดสมมูลก็ได้ แต่ถ้าเลือกอินดิเคเตอร์ได้เหมาะสมจุดสมมูลกับจุดยุติก็จะใกล้เคียงกัน
จุดยุติเป็นตัวกำหนดให้เรายุติการไทเทรต
เพื่อนำผลจากการไทเทรตไปคำนวณหาปริมาณสารที่ต้องการวิเคราะห์
เครื่องมือและอุปกรณ์สำคัญของการไทเทรต
เครื่องมือที่สำคัญสำหรับการไทเทรตประกอบด้วย
1. บิวเร็ต (burette) พร้อมที่จับบิวเร็ต (burette camp) ใช้สำหรับบรรจุสารละลายมาตรฐาน
(standard solution)
2. ขวดรูปชมพู่ erlenmeyer
flask หรือ conical
flast ใช้บรรจุสารละลายตัวอย่างที่ต้องการวิเคราะห์
(sample
solution)
3. ปีเปต (Pipet , Pipette ) ใช้สำหรับตวงสารละลายตัว (Sample solution , Solution being
titrate)อย่างเพื่อ
บรรจุลงในขวดรูปชมพู่
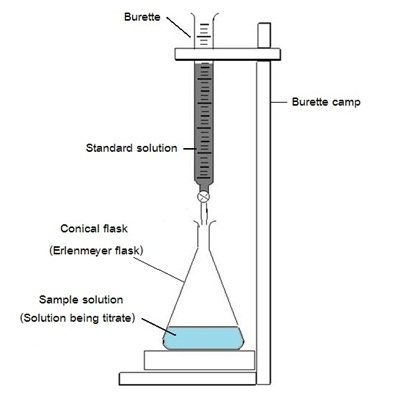
ขั้นตอนของการไทเทรต
1. บรรจุสารละลายมาตรฐานลงในบิวเร็ต ไล่ฟองอากาศบริเวณส่วนปลายด้านล่างออกให้หมด
2. ใช้ปีเปตดูดสารละลายตัวอย่างแล้วใส่ลงในขวดรูปชมพู่ (จดปริมาตรของสารละลายตัวอย่างเอาไว้ด้วย)
3. หยดอินดิเคเตอร์ 2-3 หยด
ลงในสารละลายตัวอย่าง
4.
เปิดก๊อกที่บิวเร็ตเพื่อปล่อยให้สารละลายมาตรฐานหยดลงไปทำปฏิกิริยากับสารละลายตัวอย่าง
(มีวิธีจับก๊อกที่
บิวเร็ตต้องฝึกจับให้ถูกต้อง)
แนะนำให้ใช้มือข้างที่ถนัดจับขวดรูปชมพู่เพราะต้องเขย่าอยู่ตลอดเวลา มือที่ไม่ถนัด
ใช้จับเพื่อเปิด-ปิดก๊อกที่บิวเร็ต
ขั้นตอนนี้สำคัญมากควรวางกระดาษขาวเอาไว้บนโต๊ะด้วย เพื่อช่วยให้สังเกตการ
เปลี่ยนสีของอินดิเคเตอร์ได้ง่ายขึ้น การเปลี่ยนสีในตอนแรกจะไม่ถาวร คือเมื่อเปลี่ยนสีไปแล้วชั่วครู่ก็กลับไปเป็น
อย่างเดิมอีกแสดงว่ายังไม่ถึงจุดยุติแต่ก็ใกล้มากแล้ว เมื่อถึงขั้นตอนนี้ต้องระวังมากยึ่งขึ้นในการเปิดก๊อกให้
สารละลายมาตรฐานหยดลงมา ถ้ามากไปจะเลยจุดยุติได้ง่าย
ผลการไทเทรตจะให้ไม่ได้ต้องเสียเวลาเริ่มต้นใหม่
การสังเกตสีของอินดิเคเตอร์สำหรับบอกจุดยุติ ให้ดูที่สีอ่อน ๆ จาง ๆ ไม่ให้เข้มมาก
5. ควรไทเทรตรซ้ำอย่างน้อย 3 ครั้ง
แล้วนำค่าเฉลี่ยมาคำนวณหาปริมาณสารตัวอย่าง การใช้ค่าเฉลี่ยจะช่วยให้
ความคลาดเคลื่อนน้อยลง
(คลิ้ก ชมวิธีใช้ปีเปต) (คลิ้ก
ชมวิธีไทเทรตตั้งแต่ต้นจนจบ)
การคำนวณหาปริมาณสารตัวอย่างที่ต้องการวิเคราะห์จากการไทเทรต
ข้อมูลที่ได้จากการไทเทรตที่จะใช้สำหรับการคิดคำนวณหาปริมาณสารที่ต้องการวิเคราะห์ ประกอบด้วย
1.
ปริมาตรของสารละลายตัวอย่างที่ใช้ในการไทเทรต
2.
ปริมาตรของสารละลายมาตรฐานที่ใช้ในการไทเทรต (ทราบความเข้มข้นอยู่แล้ว)
3.
สมการเคมีแสดงปฏิกิริยาที่เกิดขึ้นระหว่างสารละลายตัวอย่างกับสารละลายมาตรฐาน
ตัวอย่าง
เมื่อต้องการวิเคราะห์หาปริมาณของกรดฟอร์มิก(HCOOH)ในมดแดง 1 ตัว จึงจับมดแดง
1 ตัว แล้วรีดเอากรดทั้งหมดออกมา จากนั้นเติมน้ำกลั่นลงไปจนมีประมาตร 5 cm3 นำไปไทเทรตด้วยสารละลายมาตรฐาน NaOH ความเข้มข้น
0.01 โมล/ลิตร เมื่อถึงจุดยุติใช้สารละลายมาตรฐานไป 1 cm3 จงหาว่าในมดแดง 1
ตัวมีกรดฟอร์มิกอยู่กี่มิลลิกรัม
วิธีคิด ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
HCOOH + NaOH → HCOONa + H2O
อธิบายแนวคิด; HCOOH
ในสมการเคมีคือกรดฟอร์มิกที่มาจากมดแดง 1 ตัว NaOH
คือสารละลายมาตรฐานที่ใช้ในการไทเทรต
จากสมการจะเห็นว่าจำนวนโมลของ
HCOOH
เท่ากับจำนวนโมลของ NaOH เมื่อทราบจำนวนโมลของ NaOH ว่าเป็นเท่าไร
ก็หมายความว่ากรด HCOOH ที่มีอยู่ในมดแดง 1 ตัว
ก็จะมีเท่ากัน
เปลี่ยนจำนวนโมลของกรด
HCOOH
ให้เป็นน้ำหนักมิลลิกรัมก็จะได้คำตอบ
จำนวนโมลของ NaOH ที่ใช้ = VC / 1,000
= 1 x 0.1 / 1,000
= 5.0
x 10-5 โมล
จากสมการ จำนวนโมลของกรดฟอร์มิก = จำนวนของ NaOH ที่ใช้
= 5.0 x 10-5 โมล
คิดเป็นน้ำหนัก = 5.0 x 10-5 x
HCOOH
= 5.0 x
10-5 x 46 กรัม
เปลี่ยนเป็นมิลลิกรัม = 5.0 x 10-5 x
46 x 1000 มิลลิกรัม
ในมดแดง 1
ตัวมีกรดฟอร์มิกอยู่ =
2.3 มิลลิกรัม ตอบ
แบบฝึกหัด
1. What is the molarity of sodium hydroxide,
NaOH, if 59.0 mL of the solution is titrated to the endpoint with 24.0
mL of 0.75 M sulfuric acid (H2SO4)? (Hint:
write the balanced equation first!) (สารละลาย NaOH 59.0 mL
ไทเทรต ด้วยสารละลายมาตรฐาน H2SO4
ความเข้มข้น 0.75 M
เมื่อถึงจุดยุติใช้สารละลายมาตรฐานไป
24.0 mL
อยากทราบว่า สารละลาย NaOH มีความเข้มข้นกี่โมลาร์
2.
A 55.6 mL sample of HCl is titrated with 79.9 mL of a 1.25 M solution of
NaOH. What is the molarity of the HCl?
(สารละลาย HCl ตัวอย่างจำนวน
55.6 mL ไททเทรตด้วยสารละลายมาตรฐาน NaOH ความเข้มข้น
1.25 M พบว่าต้องใช้สารละลายมาตรฐาน 79.9 mL
อยากทราบว่าสารละลาย HCl มีความเข้มข้นกี่โมลาร์)
3.
If you have a 1.0 M solution of NaOH and a
solution of HCl with an unknown concentration, explain how you
would use titration to determine
the concentration of the HCl solution.
(Explain the steps)
(ถ้าคุณมีสารละลาย NaOH ความเข้มข้น 1.0 M และขณะเดียวกันก็มีสารละลาย HCl อยู่ด้วยแต่ไม่ทราบความเข้มข้น ถ้าต้องการไทเทรต
เพื่อหาความเข้มข้นของสารละลาย HCl จะมีขั้นตอนอย่างไร)
4. A 0.500 M
solution of hydrochloric acid is titrated against a solution of ammonia of
unknown concentration. If
7.45 mL of the acid is required to
neutralize 10.65 mL of the ammonia, what is the concentration of the
ammonia solution?
(มีสารละลายกรดไฮโดรคลอริกความเข้มข้น 0.500 M นำไปไทเทรตกับสารละลายแอมโมเนียซึ่งไม่
ทราบความเข้มข้นจำนวน 10.65 mL พบว่าต้องใช้สารละลายกรดจำนวน 7.45 mL จึงถึงจุดยุติ
อยากทราบว่า
สารละลายแอมโมเนียมีความเข้มข้นเท่าไร)
5. Exactly
50.0 mL of HClO solution of unknown concentration was titrated with 0.300 M
NaOH. An end point was
reached when 38.5 mL of the base was
added. Calculate the molarity of the
HClO solution.
(สารละลาย HClO ปริมาตร
50.0 mL
แต่ไม่ทราบความเข้มข้น
นำไปไทเทรตกับสารละลายมาตรฐาน
NaOH ความ
เข้ม้ขน 0.300 M พบว่าเม่อถึงจุดยุติในชสารละลายมาตรฐานไป 38.5 mL อยากทราบว่าสารละลาย HClO มีความ
เข้มข้นกี่โมลาร์)
6.
What
is the M of NaOH if it takes 40 ml of NaOH to reach the
equivalence point in a titration with 50 ml of 0.2 M
HCl?
(สารละลาย NaOH จำนวน
40 ml ไม่ทราบความเข้มข้น เมื่อนำไปไทเทรตด้วยสารละลาย HCl
ความเข้มข้น 0.2 M
พบว่าเมื่อถึงจุดยุติใช้สารละลาย
HCl ไป 50
ml
อยากทราบว่าสารละลาย NaOH มีความเข้มข้นกี่
โมลาร์) (ตอบ 0.25M)
7.
50 ml of 0.3 M KOH are required to
titrate 60 ml of H2SO4. What
is the M of the H2SO4?
(สารละลาย
H2SO4 จำนวน 60 ml ไม่ทราบความเข้มข้น เมื่อไทเทรตด้วยสารละลาย KOH ความเข้มข้น
0.3 M พบว่า
ต้องใช้สารละลาย
KOH ไป
50 ml
จึงถึงจุดยุติ อยากทราบว่าสารละลาย H2SO4
มีความเข้มข้นกี่โมลาร์) (ตอบ 0.125M)
8. 40
ml
of 0.1M H3PO4 are required to titrate 150 ml of NaOH to the equivalence point. What is the M of the
NaOH?
(สารละลาย NaOH
150 ml ไม่ทราบความเข้มข้น เมื่อไทเทรตด้วยสารละลาย H3PO4 ความเข้มข้น
0.1M พบว่าเมื่อถึงจุดยุติต้องใช้สารละลาย H3PO4 ไป 40 ml อยากทราบว่าสารละลาย NaOH มีความเข้มข้นกี่โมลาร์)
(ตอบ 0.08M)
9.
55 ml of 1.2 M H C2H3CO2 are used to titrate a sample of 0.67 M
Ba(OH)2. What is volume of the Ba(OH)2
used?
(ถ้าใช้สารละลาย HC2H3CO2
ความเข้มข้น
1.2 M จำนวน 55
ml ไทเทรตกับสารละลาย Ba(OH)2
ความเข้มข้น 0.67 M อยากทราบว่าจะต้องใช้สารละลาย Ba(OH)2 กี่ mL)
(ตอบ 49.3mL)
10.
90 ml of 0.25 M Ca(OH)2 are
required to titrate 100 ml of HCl. What is M of the HCl?
(สารละลาย HCl จำนวน
100 ml ไม่ทราบความเข้มข้น เมื่อไทเทรตด้วยสารละลาย Ca(OH)2 ความเข้มข้น 0.25 M
พบว่าเมื่อถึงจุดยุติต้องใช้สารละลาย
Ca(OH)2 90 ml
อยากทราบว่าสารละลาย
HCl
มีความเข้มข้นกี่โมลาร์)
(ตอบ0.45M)
11.
A
25.00 mL sample of 0.100 M CH3CO2H is titrated with 0.100 M NaOH. What is the pH of the solution at the
points where 25.0
and 25.5 mL of NaOH have been added. (Ka = 1.8
x 10-5)
(สารละลาย
CH3CO2H จำนวน 25.00 mL ความเข้มข้น
0.100 M ไทเทรตกับสารละลาย
NaOH ความเข้มข้น
0.100 M อยากทราบว่า ณ จุดที่เติม
สารละลาย NaOH ลงไป 25.0
และ 25.5 mL
สารละลายจะมี pH เท่าไร กำหนดค่า Ka = 1.8 x 10-5)
(ตอบ 8.72, 11.00)
12.
A
1.50 g sample of Vitamin C is dissolved in 100.0
mL of water and titrated with 0.250 M NaOH to the
methyl
orange equivalence point. The volume of the base used is 34.1 mL. What is the molecular weight of Vitamin C
assuming one dissociable
proton per molecule?
(วิตามินซีตัวอย่างจำนวน 1.50
กรัม ละลายน้ำ 100.0 mL จากนั้นไทเทรตด้วยสารละลาย NaOH ความเข้มข้น 0.250 M เมื่อถึงจุดยุติใช้สารละลาย
NaOH ไป 34.1 mL. อยาก ทราบว่ามวลโมเลกุลของวิตามินซีเป็นเท่าไร
สมมติว่าวิตามินซีแตกตัวได้ครั้งเดียว)
(ตอบ 176)
13.
(PAT.2 ต.ค.52) กรดอ่อนชนิดหนึ่งมีค่าคงที่ของการแตกตัว
= 1.0 x 10-6 และมีความเข้มข้น 0.02
โมลาร์ เมื่อ
นำมาไทเทรตด้วยสารละลาย NaOH ที่มีความเข้มข้นเท่ากัน
ควรเลือกใช้อินดิเคเตอร์ที่มีค่า
pKa ประมาณเท่าไร
1. 6 2. 8 3. 9 4. 10
รูปภาพที่เกี่ยวข้อง

Size : 63.83 KBs
Upload : 2013-08-12 03:38:22
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|