โครงสร้างอะตอม ตอนที่ 11 แบบฝึกหัดเรื่องการจัดอิเล็กตรอนของอะตอม (สำหรับตอนที่ 9 และ 10 )
แบบฝึกหัด
1. จงกล่าวถึงหลักการที่เกี่ยวข้องกับการจัดอิเล็กตรอนต่อไปนี้
1.
หลักของอาฟบาว กล่าวว่าอย่างไร.............................................................................................................................................................
2.
หลักของเพาลี กล่าวว่าอย่างไร.................................................................................................................................................................
3.
หลักของฮุนด์ กล่าวว่าอย่างไร ..................................................................................................................................................................
2.
ข้อความต่อไปนี้ข้อใดถูกต้อง (ตอบ 1)
1. อิเล็กตรอนในระดับพลังงานย่อยเดียวกัน มีพลังงานเท่ากัน
2. เวเลนซ์อิเล็กตรอนของทุกธาตุมีพลังงานเท่ากัน
3. เวเลนซ์อิเล็กตรอนทุกตัวของธาตุเดียวกันมีพลังงานเท่ากัน
4. เวเลนซ์อิเล็กตรอนมีพลังงานต่ำกว่าอิเล็กตรอนในระดับพลังงานถัดเข้าไป
3. ธาตุใดมีการจัดอิเล็กตรอนเต็มในทุกระดับพลังงานย่อย (ตอบ 4)
1. 23V
2. 25Mn 3.
28Ni 4. 30Zn
4. ธาตุ X มีเลขเชิงมวลเท่ากับ
32 มีจำนวนเวเลนซ์อิเล็กตรอน 6 ตัว อยู่ในระดับพลังงาน n= 3 ธาตุ X มีจำนวนนิวตรอนเท่าใด
(ตอบ 4)
1.
32 2.
18 3.
17 4.
16
5. ธาตุ E มีระดับพลังงานของอิเล็กตรอน
= 4 ระดับ มีเวเลนซ์อิเล็กตรอนเท่ากับ 4 ธาตุ E มีเลขเชิงอะตอมเท่าไร (ตอบ 2)
1.
22 2.
32 3.
34 4.
42
6. อิเล็กตรอนมีจำนวนมากที่สุดได้เท่าใดในระดับพลังงานที่
4 (ตอบ 4)
1. 8 2.
18 3.
28 4.
32
7. พลังงานไอออไนเซชั่น 6 ลำดับ
ของคาร์บอน มีค่าดังนี้ 1.093, 2.359, 4.627, 6.229, 37.838 และ
47.285 เมกาจูลต่อโมล ผลต่างของพลังงานไอออไนเซชั่น
ระหว่างระดับพลังงานที่
1 กับระดับพลังงานที่ 2 เป็นกี่เมกาจูลต่อโมล (ตอบ 3)
1. 1.266 2.
9.447 3.
31.609 4.
46.192
8. ถ้า IE1 , IE2 , IE 3 , ...คือพลังงานไอออไนเซชันลำดับที่ 1 ,2 ,3 , ... จงพิจารณาว่าการเขียนสมการแสดงพลังานไอออไนเซชันข้อใดถูกต้อง
(ตอบ 1)
1. C3+ (g ) + IE4
→ C4+ (g ) + e- 2. F (g) + e- → F-
(g ) + IE1
3. Ca (g ) + IE2 → Ca2+ (g)
+ 2e- 4.
Mn+ (g) + IE3 → Mn4+ +
3e-
9. ธาตุที่มีเวเลนซ์อิเล็กตรอน = 2 และมีเลขเชิงอะตอม
38 มีการจัดอิเล็กตรอนของธาตุอย่างไร
(ตอบ2)
1. 2 ,8, 8 ,18, 2 2. 2 ,8,
18, 8, 2 3. 2 ,18, 8, 8, 2 4. 2, 2,
18 ,8
10.
ในสภาวะปกติเวเลนซ์อิเล็กตรอนของ 20Ca
อยู่ในระดับพลังงานเท่าใด (ตอบ3)
1. n= 2 2.
n =
3 3. n = 4 4. n = 8
11.
ธาตุสมมติ 117
A ควรจะมีเวเลนซ์อิเล็กตรอนเท่าใด (ตอบ4)
1. 1 2. 3 3. 5 4. 7
12. ธาตุใดต่อไปนี้ที่จะมีอิเล็กตรอน = 4 และอยู่ในระดับพลังงาน n= 4 (ตอบ2)
1. 6 C 2. 32 Ge 3. 36 Kr 4.
26 Fe
13. ธาตุ X มีเวเลนซ์อิเล็กตรอน
= 3 อยู่ในระดับพลังงาน
n = 4 การจัดอิเล็กตรอนของ X+ เป็นดังข้อใด
(ตอบ2)
1. 2, 8, 8, 2 2. 2, 8,
18, 2 3. 2, 8, 3, 4. 2, 8, 18, 3
14. ไอออนหรืออะตอมในข้อใดที่มีการจัดอิเล็กตรอนเหมือนกับคลอไรด์ไอออน (F=9
Ne=10 Cl=17 Ca=20
) (ตอบ 4)
1. F – 2. Ne 3. Al 3+
4. Ca 2+
15. (A-net 50) พิจารณาอะตอมและไอออนต่อไปนี้ 25A2+ 15B 16C2- 44D
อะตอมหรือไอออนใดมีจำนวนอิเล็กตรอนเดี่ยวมากที่สุด (ตอบ 4)
1. A2+ 2. B 3. C2- 4. D
16. (Ent.41 ต.ค.) กำหนดเลขเชิงอะตอมของธาตุดังนี้ 11Na 12Mg 14Si 17Cl 26Fe 32As 38Sr
ข้อใดมีการจัดเรียงอิเล็กตรอนไม่เหมือนแก๊สเฉื่อย
(ตอบ 4)
1. Cl- S2- 2. Na+ Mg2+ 3. Si4+
Sr2+ 4. As3+ Fe3+
17. (Ent.42 มี.ค.)
ข้อใดประกอบด้วยไอออนที่มีการจัดอิเล็กตรอนเหมือนกัน (กำหนดเลขเชิงอะตอม B=5
N=7 F=9
Na=11 Mg=12 Al=13 S=16 Cl=17 Fe=26
Co=27 Zn=30) (ตอบ4)
1. B3+ F- Na+ 2. S2- Al3+ Cl- 3. Co2+ Fe2+ Zn2+ 4. O2- N3- Mg2+
18. (Ent.42 ต.ค.) จำนวนอิเล็กตรอนที่ระดับพลังงาน n = 5 ที่อะตอมสามารถรับได้ และการจัดอิเล็กตรอนในอะตอมของอินเดียม (In)
ซึ่งมีเลขเชิงอะตอมเท่ากับ
49 เป็นไปตามข้อใด (ตอบ4)
|
|
จำนวนอิเล็กตรอนที่สามารถรับได้
|
การจัดอิเล็กตรอนของ In
|
|
1.
|
25
|
2,8,8,18,8,5
|
|
2.
|
49
|
2,8,8,18,11,2
|
|
3.
|
50
|
2,8,18,18,1
|
|
4.
|
50
|
2,8,18,18,3
|
19. (Ent.43 ต.ค.) พิจารณาแผนภาพต่อไปนี้
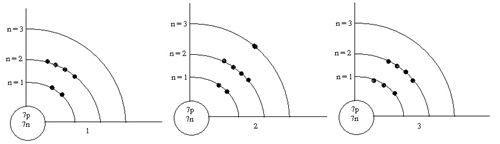
รูปใดแสดงการจัดเรียงอิเล็กตรอนในสภาวะพื้นของอะตอมไม่ถูกต้อง (ตอบ2)
1. 1
และ 2 2. 2
และ 3 3. 1 และ 3
4. 1 2
และ 3
20.
(Ent.42 มี.ค.) ถ้าพลังงานไอออไนเซชันลำดับที่ 1-5 ของธาตุ A มีค่าเท่ากับ
0.43 3.06 4.41
5.88
และ
7.98 MJ/mol
ตามลำดับ สัญลักษณ์นิวเคลียร์ของธาตุ A ข้อใดเป็นไปได้ (ตอบ4)
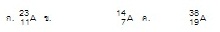
1.
ก 2. ข 3. ข และ ค 4. ก และ ค
21. (เคมีโอลิมปิค .47) จำนวนออร์บิทัลสูงสุดในระดับพลังงาน
n = 4 มีกี่ออร์บิทัล
(ตอบ2)
1. 4 2. 16 3. 8 4. 7
22. (เคมีโอลิมปิค
.47) อะตอมอิสระของธาตุชนิดใดไม่มีอิเล็กตรอนเดี่ยวทั้งสองธาตุ (ตอบ 4)
1. ธาตุที่มีเลขเชิงอะตอม 14
และ 20 2.
ธาตุที่มีเลขเชิงอะตอม 12 และ 34
3. ธาตุที่มีเลขเชิงอะตอม 9
และ 20 4.
ธาตุที่มีเลขเชิงอะตอม 20 และ 36
23.
(เคมีโอลิมปิค .47) ธาตุใดมีจำนวนอิเล็กตรอนใน s ออร์บิทัลรวมเท่ากัน (ตอบ 3)
1. 19K
37Rb 2. 19K 20Ca 3. 20Ca 35Br 4. 18Ar 19K
24.
(เคมีโอลิมปิค .47) การจัดอิเล็กตรอนของอะตอมในสถานะพื้นของธาตุใดที่มีอิเล็กตรอนเดี่ยว จำนวนมาก ที่สุด (ตอบ4)
1. 7N 2. 16S 3. 19K 4. 22Ti
25. (เคมีโอลิมปิค .43) ธาตุ X อยู่ในคาบที่
3 มีค่าพลังงานไอออไนเซชันลำดับต่าง
ๆ ดังนี้ (MJ/mol)
IE1 IE2 IE3 IE4 IE5 IE6 IE7 IE8
0.79 1.58 3.24 4.36 16.09 19.79 23.79 29.59
ถ้าไอโซโทปหนึ่งของ X มีจำนวนนิวตรอนเท่ากับ 18 สัญลักษณ์นิวเคลียร์ของธาตุ X คือข้อใด (ตอบ2)

26. (ANET’50) พิจารณาอะตอมและไอออนต่อไปนี้ 25 A2+
15 B 16 C2- 44 D
อะตอมหรือไอออนใดมีจำนวนอิเล็กตรอนเดี่ยวมากที่สุด (ตอบ4)
1. A2+ 2. B 3.
C2- 4. D
27. (ONET’51) ข้อใดเป็นการจัดอิเล็กตรอนในอะตอมที่มีเลขเชิงมวล 40
และมีจำนวนนิวตรอนเท่ากับ
21
(ตอบ2)
1. 2,8,9 2.
2,8,8,1 3. 2,8,18,8,4 4.
2,8,9,2
28. โพแทสเซี่ยมมีเลขเชิงอะตอม 19
จะมีการจัดอิเล็กตรอนดังข้อใด (ตอบ3)
1. 2,8,9 2.
2,8,18,1 3. 2,8,8,1 4. 2,8 ,7,2
29. การจัดอิเล็กตรอนของ 10Ne ในข้อใดถูกต้อง (ตอบ1)
1. 1s2 2s2 2p6 2. 1s2 2s2 3s2 3p4 3. 1s2 2s2 3s2 3p3 4. 1s2 2s2 3p5 3s1
30. ถ้าการจัดอิเล็กตรอนของ 22Ti เป็นดังนี้ ; 1s2 2s2 2p6 3s2 3p6 4s2 3d2 ข้อใดเป็นการเขียนแสดงการจัดอิเล็กตรอนได้ถูกต้อง
(ตอบ2)
1. [Ar] 3d2 2. [Ar]
4s2 3d2 3. [Ne]
4s2 3d2 4. [Ar]
3d2
31. (PAT.2 ก.ค.53) ข้อความต่อไปนี้ข้อใดผิด (ตอบ2)
1. ออร์บิทัลชนิด d จะเริ่มมีในระดับพลังงาน n = 3
2. ระดับพลังงานย่อย f ในระดับพลังงาน n=3 มีจำนวน 7
ออร์บิทัล
3. ในระดับพลังงาน n = 3 มีจำนวนออร์บิทัลทั้งหมด 9
ออร์บิทัล
4. ในระดับพลังงาน n = 4 มีจำนวนระดับพลังงานย่อย 4
ระดับ
32.
(PAT.2 มี.ค. 52) เมื่อเร็ว ๆ
นีมีนักวิทยาศาสตร์ชาติหนึ่งอ้างว่า
ได้สังเคราะห์ธาตุที่มีเลขเชิงอะตอมเท่ากับ 122 ซึ่งควรจะมีอิเล็กตรอนวงนอกสุดอยู่ใน
g ออร์บิทัล
จงอาศัยความรู้ เรื่องการจัดเรียงอิเล็กตรอนทำนายว่าธาตุนี้ควรจะมีอิเล็กตรอนอยู่ใน
g ออร์บิทัลจำนวนเท่าไร
(ตอบ2)
1. 1 ตัว 2. 2 ตัว 3. 3 ตัว 4. 4 ตัว
33.
จงพิจารณาข้อความต่อไปนี้
ก. ประสาทของคนสามารถรับคลื่นที่มีความยาวคลื่นตั้งแต่
380 ถึง 950 นาโนเมตร
ข. การหักเหของแสงที่มีความยาวคลื่นที่ต่างกันในตัวกลางชนิดเดียวกันจะเท่ากัน
ค. พลังค์ได้ข้อสรุปว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะเป็นสัดส่วนโดยตรงกับความถี่ของคลื่นนั้น
ง. แสงสีใดหากมีค่าความยาวคลื่นของสเปกตรัมมาก
แสงสีนั้นจะมีค่าพลังงานน้อย
จ. ค่าพลังงานไอออนไนเซชันลำดับที่
1 (IE) ไม่ว่าจะเป็นของธาตุใดจะมีค่าต่ำสุดเมื่อเทียบกับพลังงาน
ไอออนไนเซชัน
ลำดับอื่นๆของธาตุเดียวกัน
ข้อใดมีข้อถูกต้องมากที่สุด (ตอบ2)
1. ก ข ค 2. ค ง จ 3.
ก ค จ 4. ข ง ก
34. ธาตุใดที่มีการจัดอิเล็กตรอนเต็มในทุกระดับพลังงานย่อย (ตอบ4)
1. V เลขเชิงอะตอม 23 2. Mn เลขเชิงอะตอม
25
3. Ni เลขเชิงอะตอม 28 4. Zn เลขเชิงอะตอม
30
35. อะตอมของธาตุใดเมื่อกลายเป็นไอออนจะมีจำนวนอิเล็กตรอนเพิ่มขึ้น (สัญลักษณ์ของธาตุเป็นสัญลักษณ์สมมติ) (ตอบ2)
1. H ( Z = 26 ) 2. I ( Z = 53 ) 3. J ( Z = 56 ) 4.
K ( Z = 80 )
36. ธาตุ E มีระดับพลังงานของอิเล็กตรอน
= 4 ระดับ มีเวเลนซ์อิเล็กตรอนเท่ากับ 4 ธาตุ E มีเลขเชิงอะตอมเท่าไร (ตอบ2)
1. 2 2.
32 3.
34 4.
42
37. ธาตุ X มีเลขเชิงมวลเท่ากับ 32 มีจำนวนเวเลนซ์อิเล็กตรอนซึ่งอยู่ในระดับพลังงานที่ 3 เท่ากับ 6 ธาตุ X มีจำนวนนิวตรอนเท่าใด (ตอบ2)
1. 32 2. 18 3.
17 4.
16
คำชี้แจง ตารางต่อไปนี้แสดงค่า
IE 4 ค่าแรก (หน่วยเป็น kJ/
mol) ของธาตุ 5 ชนิด คือ A ถึง E ( A B C D E เป็นตัวอักษรสมมติไม่ใช่สัญลักษณ์ของธาตุ) จงใช้ข้อมูลที่กำหนดให้ตอบคำถามข้อ 38 -
40
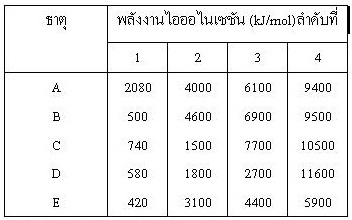
38. ธาตุคู่ใดมีจำนวนอิเล็กตรอนวงนอกเท่ากัน
(ตอบ2)
1. D กับ E 2. B กับ E 3. C กับ D 4. B กับ D
39. ธาตุใดอยู่ในหมู่ที่ IIIA (ตอบ4)
1. A 2.
B 3.
C 4.
D
40. ธาตุที่มีเลขเชิงอะตอมเท่าใดต่อไปนี้มีอิเล็กตรอนวงนอกเท่ากับธาตุ C (ตอบ3)
1. 13 2.
19 3.
20 4.
14
41.
(O-NET ก.พ.54) ธาตุ 82Pb เป็นธาตุในหมู่เดียวกับ 6C
อนุภาคใดต่อไปนี้ที่มีจำนวนอิเล็กตรอนชั้นในและชั้นนอกสุดเท่ากัน (ตอบ3)
1. Pb2- 2. Pb 3. Pb2+ 4.
Pb4+
42. Which of the following
electron configurations is the ground state for an atom. (ans.c)
(ข้อใดแสดงการจัดอิเล็กตรอนในภาวะปกติ)
a) [Ne]3s23p64f4 b) 1s12s1 c) 1s22s22p63s1
d) 1s22s12p3 e) [Ne]3s23p34s1
43. Which of the following
represents an excited state of an atom?
(ans.c)
(การจัดอิเล็กตรอนดังข้อใดแสดงว่าอะตอมอยู่ในภาวะถูกกระตุ้น)
a) 1s22s22p63s1 b) [Ne]3s23p64s23d8 c) [Ne]3s23p64s13d2
d) 1s22s1 e) [Ne]3s23p64s23d1
44. Which of the following electron
configurations is the ground state for an atom.
(ans.d)
(การจัดอิเล็กตรอนดังข้อใดแสดงว่าอะตอมอยู่ในภาวะปกติ)
a) [Ne]3s23p34s1 b) [Ne]3s23p64f4 c) 1s22s12p3
d) 1s22s22p63s1 e) 1s12s1
45. Which of the following represents an excited
state of an atom? (ans.d)
(การจัดอิเล็กตรอนดังข้อใดแสดงว่าอะตอมอยู่ในภาวะถูกกระตุ้น)
a) [Ne]3s23p64s23d1 b) [Ne]3s23p64s23d8 c) [Ne]3s23p64s13d2
d) 1s22s22p53s1 e) 1s22s2
46. Which of the following representation of
excited states of atoms is impossible?
(ans.d)
(การจัดอิเล็กตรอนของอะตอมที่อยู่ในภาวะถูกกระตุ้นดังข้อใดเป็นไปไม่ได้)
a) [Ne]3s23p34s1 b) 1s22s22p43s2 c) 1s12s1
d) [Ne]3s23p64s33d2 e) [Ne]3s23p64s13d2
รูปภาพที่เกี่ยวข้อง

Size : 18.69 KBs
Upload : 2012-11-20 20:10:50
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|