ปริมาณสารสัมพันธ์ ตอนที่ 9/6 ร้อยละของผลได้ของปฏิกิริยา
ร้อยละของผลได้ (percentage yield)
การคิดคำนวณเกี่ยวกับปริมาณสารจากสมการเคมีในรูปแบบต่าง ๆ ดังที่ผ่านมานี้ เป็นการคิดคำนวณเชิงทฤษฎี เช่น จากปฏิกิริยาดังสมการ 2H2 + O2 → H2O เรากล่าวว่า
ถ้าใช้ H2 จำนวน 2 โมล ทำปฏิกิริยากับ O2 จำนวน 1 โมล จะได้ H2O เป็นผลิตภัณฑ์จำนวน 1 โมล หรือคิดเป็นน้ำหนัก 18.0 กรัม ปริมาณของผลิตภัณฑ์ที่ได้เมื่อคิดตามสมการเคมี
เราเรียกว่าผลได้เชิงทฤษฎี (theoretical yield หรือ theoretical product) แต่ในการทดลองจริงจะพบว่าปริมาณของผลิตภัณฑ์ที่ได้จากการทดลอง เราเรียกว่าผลได้จริง (actual yield หรือ actual product) มักจะน้อยกว่าผลได้เชิงทฤษฎี จึงมีการคิดร้อยละของผลได้ (percentage yield หรือ percentage product) ดังสมการ
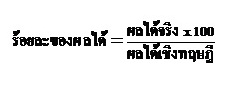

แบบฝึกหัด
1. (Ent 42 ต.ค. อัตนัย) ในการเตรียมเอสเทอร์จากการผสม CH3CH2COOH 5.92 กรัม กับ C3H7OH 6 กรัม จะได้ผลิตภัณฑ์เป็น CH3CH2COOC3H7 6.96 กรัม
ร้อยละของผลได้ที่เกิดขึ้นมีค่าเท่าไร
CH3CH2COOH + C3H7OH → CH3CH2COOC3H7 + H2O
2. (Ent 42 ต.ค. อัตนัย) พิจารณาปฏิกิริยาสมมติต่อไปนี้ 2A + 3B → C จากการทดลองเริ่มต้นด้วยสาร A และสาร B ปริมาณต่างๆ กัน พบว่าร้อยละของผลได้จะมีค่าเท่ากับ 80 เสมอ ถ้าต้องการผลิตสาร C 160 กรัม โดยเริ่มต้นจากสาร B 500 กรัม จะต้องใช้สาร A อย่างน้อยที่สุดกี่กรัมจึงจะได้สาร C ในปริมาณที่ต้องการ กำหนดมวลโมเลกุลของ A = 200 มวลโมเลกุลของ B = 500 มวลโมเลกุลของ C = 1000
3. (Ent. 44 มี.ค.อัตนัย) สารประกอบ A B และ C มีองค์ประกอบของธาตุดังตาราง
|
สารประกอบ
|
ร้อยละโดยมวล
|
มวลโมเลกุล
|
|
P
|
O
|
H
|
|
A
|
43.66
|
56.24
|
-
|
284
|
|
B
|
-
|
88.89
|
11.11
|
18
|
|
C
|
31.63
|
65.31
|
3.06
|
98
|
จากการทดลองพบว่าเมื่อผสม A 2 โมล กับ B 5 โมล ได้ผลิตภัณฑ์เป็น C 2 โมล จงหาร้อยละของผลได้จากการทดลองนี้
4. ตัวทำละลาย D มีจุดเดือด 62 0C และมีค่า Kb = 4.0 oC mol-1 kg-1 เมื่อละลายสาร A B และ C ในตัวทำละลาย D ได้สารละลายที่มีจุดเดือดดังตาราง
|
สาร
|
น้ำหนักของตัวถูกละลาย(g) ในตัวทำละลาย D 100 กรัม
|
จุดเดือด 0C
|
|
A
|
7.5
|
64
|
|
B
|
10.0
|
66
|
|
C
|
18.0
|
68
|
สาร A ทำปฏิกิริยากับสาร B ได้สาร C ดังสมการ 2A + B → 3C เมื่อนำสาร A 45 กรัม ทำปฏิกิริยากับสาร B 10 กรัม จะได้สาร C 27 กรัม จงหาร้อยละของผลได้ของปฏิกิริยานี้
5. (Ent 45 มี.ค. อัตนัย) ในการถลุงแร่ตะกั่วจากแร่กาเลนา (PbS) ประกอบด้วย 2 ขั้นตอนคือ ขั้นที่ 1 เผาแร่ในอากาศจะเกิดสารประกอบเลด(II) ออกไซด์ มีร้อยละของผลได้เท่ากับ 96.5 ขั้นที่ 2 รีดิวซ์เลด(II)ออกไซด์ด้วยแก๊สคาร์บอนมอนอกไซด์ได้ตะกั่ว มีร้อยละของผลได้เท่ากับ 80 ถ้าต้องการตะกั่ว 41.1 กรัม จะต้องใช้แร่กาเลนากี่กรัม (Pb=207 S=32 O=16)
I. PdS + O2 → PbO + SO2
II. PbO + CO → Pb + CO2
6. (เคมีโอลิมปิค 2546) สารประกอบชนิดหนึ่งมีมวลโมเลกุลเท่ากับ 100 และสารประกอบชนิดนี้สามารถสังเคราะห์ได้ด้วย 6 ขั้นตอนจากสารตั้งต้น โดยแต่ละขั้นตอนให้ผลิตภัณฑ์ที่แท้จริงเพียง 50 % ถ้าเริ่มต้นด้วยสารตั้งต้น 30 กรัม จะได้ผลิตภัณฑ์สุดท้ายกี่กรัม (กำหนดมวลโมเลกุลของสารตั้งต้นเท่ากับ 80)
1. 0.85 กรัม 2. 0.72 กรัม 3. 0.59 กรัม 4. 0.34 กรัม
7. (เคมีโอลิมปิค 2547) โลหะแมกนีเซียมทำปฏิกิริยากับกรดไฮโดรคลอริกได้แมกนีเซียมคลอไรด์และแก๊สไฮโดรเจน ถ้าผสมแมกนีเซียม 15.6 กรัม กับกรดไฮโดรคลอริกที่มากเกินพอ พบว่าเกิด MgCl2 40.00 กรัม จงหาร้อยละของ MgCl2 ที่เกิดขึ้น (Mg=24 Cl=35.5)
1. 44.5 2. 54.5 3. 64.5 4. 74.5
8. (Ent.43 ต.ค.) ปฏิกิริยาระหว่างสารประกอบ A และ B เป็นดังสมการ A + 3B → 4C จากการทดลองเพื่อทดสอบประสิทธิภาพของปฏิกิริยานี้ พบว่าร้อยละของผลได้มีค่า 75% ถ้าต้องการเตรียมสารประกอบ C 6 โมล จะต้องใช้ A และ B เท่าไร
|
|
A
|
B
|
|
1.
|
1
|
3
|
|
2.
|
1.1
|
3.3
|
|
3.
|
1.5
|
4.5
|
|
4.
|
2
|
6
|
9. (เคมีโอลิมปิค 2544) กระบวนการผลิต HNO3 ในอุตสาหกรรมประกอบด้วย 3 ขั้นตอน ดังนี้
I. 4NH3 + 5O2 → 4NO + 6H2O
II. 2NO + O2 → 2NO2
III. 3NO2 + H2O è 2HNO3 + NO
ร้อยละของผลได้ในขั้นที่ I II และ III เทากับ 85.0 83.0 และ 87.0 ตามลำดับ อยากทราบว่าจะเกิด HNO3 ขึ้นกี่กรัม ถ้าเริ่มต้นก๊าซ NH3 52.125 กรัม (มวลโมเลกุลของ NH3 และ HNO3 เท่ากับ 17 และ 63 ตามลำดับ)
1. 69 กรัม 2. 79 กรัม 3. 89 กรัม 4. 99 กรัม
10. (เคมีโอลิมปิค 2546) ในการเตรียมเอสเทอร์ เมื่อใช้กรดบิวทีริก (C3H7COOH) 10 g ทำปฏิกิริยากับเอทานอล (C2H6O) 3.14 g โดยใช้กรดซัลฟิวริกเข้มข้นเป็นตัวเร่ง ได้ผลิตภัณฑ์เป็น เอทิลบิวทีเรต (C3H7COOC2H5) 5.3 g ร้อยละของผลได้มีค่าเท่าไร
C3H7COOH + C2H6O → C3H7COOC2H5 + H2O
1. 35.00 2. 40.33 3. 33.45 4. 66.92
11. (เคมีโอลิมปิค 2546) ถ้าต้องการเตรียม O2 8.0 กรัม จากปฏิกิริยาการเผาโซเดียมไนเตรต (NaNO3) ดังสมการ 2NaNO3(s) → 2NaNO2 + O2 จะต้องใช้โซเดียมไนเตรตหนักกี่กรัม ถ้าร้อยละของผลได้ของปฏิกิริยาเท่ากับ 75.00
1. 13.3 2. 34.0 3. 42.5 4. 56.95
12. (เคมีโอลิมปิค 2547) โลหะแมกนีเซียมทำปฏิกิริยากับกรดไฮโดรคลอริกได้แมกนีเซียมคลอไรด์และแก๊สไฮโดรเจน ถ้าผสมแมกนีเซียม 15.6 กรัม กับกรดไฮโดรคลอริกที่มากเกินพอ พบว่าเกิด MgCl2 40.0 กรัม จงหาร้อยละของ MgCl2 ที่เกิดขึ้น (Mg=24 Cl=35.5)
Mg + HCl → MgCl2 + H2
1. 44.5 2. 54.5 3. 64.5 4. 74.5
Appendix
1. Calculate the percent yield for the reaction: P4(s) + 6Cl2(g) → 4PCl3(l)
if 75.0 g of phosphorus react with excess chlorine gas to produce 111.0 g of phosphorus trichloride.
(ฟอสฟอรัส 75.0 กรัม ทำปฏิกิริยากับก๊าซคลอรีนจำนวนมากเกินพอดังสมการ P4(s) + 6Cl2(g) → 4PCl3(l) ปรากฏว่ามีฟอสฟอรัสไตรคลอไรด์เกิดขึ้น 111.0 กรัม
จงคำนวณหาร้อยละของผลได้ของปฏิกิริยา) ; ตอบ 33.3%
2. Calculate the percent yield for an experiment in which 5.50 g of SOCl2 was obtained in a reaction of 5.80 g of SO2 with excess PCl5.
Use the following equation:
SO2(l) + PCl5(l) → SOCl2 + POCl3(l).
(ซัลเฟอร์ไดออกไซด์ 5.80 กรัม ทำปฏิกิริยากับ PCl5 จำนวนมากเกินพอ พบว่ามี SOCl2 เกิดขึ้น 5.50 กรัม จงหาร้อยละของผลได้ของปฏิกิริยา กำหนดสมการดังนี้ ;
SO2(l) + PCl5(l) → SOCl2 + POCl3(l)) ; ตอบ 51.0%
3. When iron (II) hydroxide is mixed with phosphoric acid, iron (II) phosphate precipitate results.
If 3.20 g of Fe(OH)2 is treated with 2.50 g of phosphoric acid, If 3.99 g of Fe3(PO4)2 is actually obtained, what is the percent yield?
(เมื่อ Fe(OH)2 3.20 กรัม ทำปฏิกิริยากับกรด H3PO4 2.50 กรัม จะได้ตะกอนของ Fe3(PO4)2 เป็นผลิตภัณฑ์ จำนวน 3.99 กรัม ร้อยละของผลได้เป็นเท่าไร)
; ตอบ 94.0 %
4. A common laboratory preparation for small quantities of O2 is to decompose KClO3 by heating:
KClO3(s) → KCl(s) + O2 (g)
If the decomposition of 2.00 g of KClO3 give 0.720 g of O2, what is the percentage yield for the reaction ? Suggest a reason for
the actual yield’s being less than the theoretical yield.
(ในการเตรียมก๊าซ O2 จำนวนไม่มากเพื่อใช้ในห้องทดลอง ทำได้โดยการเผา KClO3 ให้เกิดการสลายตัว ถ้าในการทดลองครั้งหนึ่ง ใช้ KClO3 2.00 กรัม
ปรากฏว่าเมื่อเผาแล้วสลายตัวให้ก๊าซ O2 0.720 กรัม จงหาร้อยละของผลได้ของปฏิกิริยานี้ ; แนะนำว่าผลได้จริงย่อมน้อยกว่าผลได้ทางทฤษฎี)
5. A student reacts benzene,C6H6 , with bromine ,Br2 , in an attempt prepare bromobenzene, C6H5Br:
C6H6 + Br2 → C6H5Br + HBr
(a) What is the theoretical yield of bromobenzene in this reaction when 30.0 g of benzene reacts with 65.0 g of bromine ?
(b) If the actual yield of bromobenzene was 56.7 g, What was the percentage yield ?
(นักเรียนคนหนึ่งเตรียมโบรโมเบนซีน (C6H5Br) จากปฏิกิริยาระหว่าเบนซีน (C6H6) กับโบรมีน (Br2) ดังสมการ
- ถ้าใช้เบนซีน 30.0 กรัม ทำปฏิกิริยากับโบรมีน 65.0 กรัม ผลได้ทางทฤษฎีของโบรโมเบนซีน ( C6H5Br ) เป็นเท่าไร (กี่กรัม) ; (Br=80)
- ถ้าปรากฏว่าได้โบรโมเบนซีน 56.7 กรัม จงหาว่าร้อยละของผลได้เป็นเท่าไร)
6. Diethyl ether can be made by the reaction. ; 2C2H5OH → (C2H5)2O + H2O , If a chemist using 517 g of ethanol, C2H5OH,
produced 391 g of diethyl ether, (C2H5)2O. What is the percentage yield? (ไดเอทิลอีเทอร์ (C2H5)2O) ผลิตได้จากปฏิกิริยาดังสมการ :
2C2H5OH → (C2H5)2O + H2O ถ้านักเคมีคนหนึ่งใช้ C2H5OH 517 กรัม สามารถผลิต (C2H5)2O ได้ 391 กรัม ร้อยละของผลได้ของปฏิกิริยาเป็นเท่าไร)
7. A reaction between solid sulfur (S6) and oxygen (O2) produces sulfur dioxide. S6(s) + O2(g) → SO2(g) ,The reaction started with 384 grams of S6 (s).
Assume an unlimited supply of oxygen. What is the theoretical yield and the percentage yield if only 680 grams of sulfur dioxide are produced?
(ปฏิกิริยาระหว่างซัลเฟอร์ (S6)กับออกซิเจน (O2) จะได้ซัลเฟอร์ไดออกไซด์เป็นผลิตภัณฑ์ ถ้าใช้ S6 384 กรัม ปรากฏว่ามี SO2 เกิดขึ้น 680 กรัม จงหาว่าปฏิกิริยามีผลได้ทางทฤษฎี
และร้อยละของผลได้เท่าไร สมมติว่ามีปริมาณของ O2 ไม่จำกัด) ตอบ ผลได้ทางทฤษฎี 768 กรัม ร้อยละของผลได้ 89
8. A student completely reacts 5.00 g of magnesium with an excess of oxygen to produce magnesium oxide. Analysis reveals 8.10 g of
magnesium oxide. What is the student's percentage yield?
2Mg + O2 → 2MgO
(นักเรียนคนหนึ่งศึกษาปฏิกิริยาระหว่างแมกนีเซียม 5.00 กรัม กับก๊าซออกซิเจนที่มากเกินพอ พบว่ามีแมกนีเซียมออกไซด์เกิดขึ้น 8.10 กรัม ร้อยละของผลได้ของปฏิกิริยาเป็นเท่าไร)
ตอบ 97.6
9. Consider the chemical reaction: FeCl3(aq) + H2S(g) → Fe2S3(g) + HCl(g)
If 90.0 grams of FeCl3 react with 52. 0 grams of H2S , produced 57. 5 grams of HCl, what is the percent yield? (Fe=56 Cl=35.5 S=32 H=1)
(พิจารณาปฏิกิริยาต่อไปนี้ ; FeCl3(aq) + H2S(g) → Fe2S3(g) + HCl(g) ; ถ้าใช้ FeCl3 90.0 กรัม ทำปฏิกิริยากับ H2S 52.0 กรัม ปรากฏว่ามี HCl เกิดขึ้น 57.5 กรัม
ร้อยละของผลได้ของปฏิกิริยาเป็นเท่าใด)
10. Adipic acid,H2C6H8O4, is an material used for the production of nylon. It is made commercially by a controlled reaction between cyclohexane,
C6H12, and O2: 2C6H12 + 5O2 → 2H2C6H8O4 + 2H2O
a. Assume that you carry out this reaction starting with 25.0 g of cyclohexane, and that cyclohexane is the limiting reactant. What is the
theoretical yield of adipic acid? Ans. 43.5 g
b. If you obtain 33.5 g of adipic acid from your reaction, what is the percent yield of adipic acid? Ans. 77 %
(กรดอะไดปิก (H2C6H8O4) เป็นสารตั้งต้นชนิดหนึ่งสำหรับผลิตไนลอน ผลิตได้จากปฏิกิริยาระหว่างไซโคลเฮกเซน (C6H12) กับ ก๊าซ O2 ดังสมการ ;
2C6H12 + 5O2 → 2H2C6H8O4 + 2H2O
10.1 ถ้าใช้ไซโคลเฮกเซน 25.0 กรัม และไซโคลเฮกเซนดังกล่าวนี้เป็นสารกำหนดปริมาณ ปฏิกิริยาจะมีผลได้เชิงทฤษฎีเท่าไร
10.2 ถ้าปากฎว่าผลิตกรดอะไดปิกได้ 33.5 กรัม ร้อยละของผลได้ของปฏิกิริยาเป็นเท่าไร)
11. The reaction of 10.23 g of Fe2O3 with excess C according to the following reaction yields 4.98 g of Fe.
What is the percent yield? (Atomic weights: Fe = 55.85, C = 12.01, O = 16.00).
Fe2O3 + 3 C → 2 Fe + 3 CO ;(Fe2O3 10.23 กรัม ทำปฏิกิริยากับ C ซึ่งมากเกินพอ ปรากฏว่ามี Fe เกิดขึ้น 4.98 กรัม
ปฏิกิริยามีร้อยละของผลได้เท่าไร)
12. Reaction of 1.00 mole CH4 with excess Cl2 yields 96.8 g CCl4. What is the percent yield of the reaction?
(Atomic weights: C = 12.01, H = 1.008, Cl = 35.45). (Ans.62.9)
CH4 + 4 Cl2→ CCl4 + 4 HCl ; ( CH4 จำนวน 1.00 โมล ทำปฏิกิริยากับ Cl2 ซึ่งมากเกินพอ ได้ผลิตภัณฑ์ CCl4 96.8 กรัม
ปฏิกิริยามีร้อยละของผลได้เท่าไร)
13. The reaction of 11 g of N2H4 with excess H2O2 according to the following reaction yields 35 g of HNO3.
What is the percent yield? (Atomic weights: N = 14.01, H = 1.008, O = 16.00). (Ans.81)
7 H2O2 + N2H4 → 2 HNO3 + 8 H2O ; (N2H4 11 กรัม ทำปฏิกิริยากับ H2O2 ซึ่งมากเกินพอ ได้ผลิตภัณฑ์ HNO3 จำนวน 35 กรัม
ปฏิกิริยามีร้อยละของผลได้เท่าไร)
14. Diethyl ether, (C2H5)2O, is prepared for anesthetic use by the reaction of ethanol with sulfuric acid.
What is the percent yield if 1.00 kg of C2H5OH yields 0.766 kg of (C2H5)2O? (Atomic weights: C = 12.01;
H = 1.008; S = 32.06; O = 16.00). (Ans.95.2) 2 C2H5OH + H2SO4 → (C2H5)2O + H2SO4 + H2O
(ไดเอทิลอีเทอร์ (C2H5)2O ใช้เป็นยาชา เตรียมได้จากปฏิกิริยาระหว่างเอทานอลกับกรดซัลฟิวริก ถ้าใช้ C2H5OH (เอทานอล) 1.00 กิโลกรัม
ปรากฏว่าได้เอทิลอีเทอร์ 0.766 กิโลกรัม ปฏิกิริยามีร้อยละของผลได้เท่าไร)
15. A sample of lime, CaO, weighing 69 g was prepared by heating 131 g of limestone, CaCO3. What was the percent yield
of the reaction? (Atomic weights: Ca = 40.08, C = 12.01, O = 16.00). (Ans.94)
CaCO3 → CaO + CO2 ; (เมื่อให้ความร้อนแก่หินปูน (CaCO3) 131 กรัม ปรากฏว่าสลายตัวได้ CaO 69 กรัม ปฏิกิริยามีร้อยละของผลได้เท่าไร)
16. The mass of CaF2 that results from the reaction of 3.00 g of calcium and 2.00 g of fluorine is 4.02 g.
What is the percent yield? (Atomic weights: Ca = 40.08, F = 19.00). (Ans. 97.8) Ca + F2 → CaF2
(ปฏิกิริยาระหว่าโลหะแคลเซียม (Ca) 3.00 กรัม ทำปฏิกิริยากับฟลูออรีน 4.02 กรัม ปรากฏว่าได้ CaF2 4.02 กรัม
ปฏิกิริยามีร้อยละของผลได้เท่าไร)
17. The mass of ClF3 produced from 12.4 g of chlorine and 14.0 g of fluorine is 20.5 g. What is the percent yield?
(Atomic weights: Cl = 35.45, F = 19.0). (Ans. 90.3) Cl2 + 3 F2 → 2 ClF3
(ก๊าซคลอรีน 12.4 กรัม ทำปฏิกิริยากับก๊าซฟลูออรีน 14.0 กรัม พบว่ามี ClF3 เกิดขึ้น 20.5 กรัม ปฏิกิริยามีร้อยละของผลได้เท่าไร)
18. The mass of Li2O formed when 2.00 g of lithium reacts with 2.00 g of oxygen is 3.02 g. What is the percent yield?
(Atomic weights: Li = 6.94, O = 16.00). (Ans. 80.7) 4 Li + O2 → 2 Li2O
(เมื่อลิเทียม 2.00 กรัม ทำปฏิกิริยากับออกซิเจน 2.00 กรัม ปรากฏว่ามีลิเทียมออกไซด์ (Li2O) เกิดขึ้น 3.02 กรัม ปฏิกิริยามีร้อยละของผลได้เท่าไร)
19. The mass of SbCl3 that results from the reaction of 3.00 g of antimony and 2.00 g of chlorine is 5.05 g.
What is the percent yield? (Atomic weights: Sb = 121.8, Cl = 35.45). (Ans.84.9) Sb4 + 6 Cl2 → 4 SbCl3
(อัลติโมนี 3.00 กรัม ทำปฏิกิริยากับก๊าซคลอรีน 2.00 กรัม พบว่ามี SbCl3 เกิดขึ้น 5.05 กรัม ร้อยละของผลได้เป็นเท่าไร)
รูปภาพที่เกี่ยวข้อง

Size : 35.62 KBs
Upload : 2013-08-08 16:51:32
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|